
| A、混合气体的压强 |
| B、混合气体的密度 |
| C、混合气体的物质的量 |
| D、混合气体中C和D的物质的量比 |


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
| A、14.2g | B、4.24g |
| C、11.44 | D、无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应的氧化剂是MnO4- |
| B、该反应右边方框内的产物是OH- |
| C、该反应电子转移总数是5e- |
| D、配平该反应后,H+的系数是16 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 27℃ | 2000℃ |
| K值 | 3.84×10-31 | 0.1 |
| 温度 | 25℃ | 350℃ | 400℃ | 450℃ |
| K值 | 5×108 | 1.847 | 0.507 | 0.152 |

查看答案和解析>>
科目:高中化学 来源: 题型:
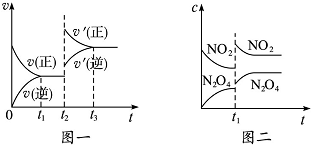
| A、图一t2时改变的条件可能是升高了温度或增大了压强 |
| B、图一t2时改变的条件一定是增大了反应物的浓度 |
| C、图二t1时改变的条件可能是升高了温度或增大了压强 |
| D、若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若B是气体,增大A的浓度会使B转化率增大 |
| B、若增大A的浓度,平衡体系颜色加深,D不一定是有颜色的气体 |
| C、升高温度,C百分含量减少,说明正反应是放热反应 |
| D、增大压强,平衡不移动,说明B、D是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含NaOH 0.1mol |
| B、c(Na+)为1mol/L |
| C、含NaOH 4g |
| D、c(OH-)为0.1mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com