
【题目】下列叙述正确的是
A. 金属腐蚀就是金属失去电子被还原的过程
B. 铜板上的铁铆钉在潮湿的空气中直接发生反应:Fe- 3e- = Fe3+,继而形成铁锈
C. 将水库中的水闸(钢板)与直流电源的负极相连接,可防止水闸被腐蚀
D. 合金的熔点高于它的任何一种金属成分
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案科目:高中化学 来源: 题型:
【题目】【选修3:物质结构与性质】X、Y、M、Z、R为前四周期元素,且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH3;M是周期表中电负性最大的元素;Z基态原子的M层是K层电子数的3倍;R2+离子的3d轨道中有9个电子。请回答下列问题:
(1)基态Y原子的价电子排布图是___________;Z所在周期中第一电离能最大的主族元素是___________(元素名称)。
(2)XY2离子的立体构型是___________;R2+的水合离子[R(H2O)4]2+中,提供孤电子对的原子是___________(元素符号)。
(3)已知XH3易与R2+形成配离子,但XM3不易与R2+形成配离子,其原因是______________________。
(4)Y与R所形成的化合物晶体晶胞如下图所示,该晶体的化学式:___________;晶胞参数如下图所示,则该晶胞密度是___________g·cm-3(列式并计算结果,保留小数点儿后一位)。

(5)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是___________(填标号)。

a.CF4b.CH4c.NH4+d.H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+3B(g) ![]() 2C(g)+D(g) 在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
2C(g)+D(g) 在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
A.VA=0.15mol(Lmin)﹣1 B.VB=0.6 mol(Lmin)﹣1
C.VC=0.4 mol(Lmin)﹣1 D.VD=0.01 mol(Ls)﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CH4催化还原NOX可以消除氮氧化物的污染.例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160kJmol-1
已知NO、 NO2混合气体的密度是相同条件下氢气密度的17倍,16g甲烷和该混合气体恰好完全反应生成N2、 CO2、H2O(g)放出1042.8 kJ的热量,则△H1是( )
A.-574kJmol-1 B.-691.2kJmol-1 C.-867kJmol-1 D.-925.6kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列两组热化学方程式中,有关ΔH的比较正确的是( )
①NaOH(aq)+![]() H2SO4(浓)=
H2SO4(浓)=![]() Na2SO4(aq)+H2O(l) ΔH1
Na2SO4(aq)+H2O(l) ΔH1
NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l) ΔH2
②CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH3
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH4
A.ΔH1>ΔH2;ΔH3<ΔH4 B.ΔH1>ΔH2;ΔH3>ΔH4
C.ΔH1=ΔH2;ΔH3<ΔH4 D.ΔH1<ΔH2;ΔH3>ΔH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用硫铁矿(主要成分FeS2)生产硫酸和绿矾(FeSO4·7H2O)的工业流程示意图如下:
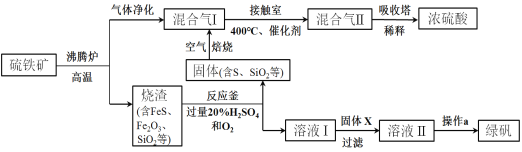
(1)沸腾炉中,硫铁矿进行粉碎处理的目的是 。
(2)接触室中,发生的主要反应是SO2与O2的反应,其化学方程式是 。
(3)反应釜中,烧渣经过反应转化为溶液I和固体。
① 烧渣中的FeS在反应中做 剂(填“氧化”或“还原”)。
② 溶液I中所含溶质的化学式是 。
(4)操作a的主要步骤是:加热浓缩、 、过滤洗涤。
(5)流程中,固体X可以选择硫铁矿(FeS2)或 ;当固体X为硫铁矿(FeS2)时,将溶液I与固体X发生反应的离子方程式补充完整:
FeS2+![]() +
+![]() ===
===![]() Fe2++
Fe2++![]() SO42-+
SO42-+![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]()
![]()
![]() 。25℃时,调节初始浓度为1.0 molL-1 的Na2CrO4溶液的pH,测定平衡时溶液中c(
。25℃时,调节初始浓度为1.0 molL-1 的Na2CrO4溶液的pH,测定平衡时溶液中c(![]() )和c(H+),获得如右图所示的曲线。下列说法不正确的是
)和c(H+),获得如右图所示的曲线。下列说法不正确的是
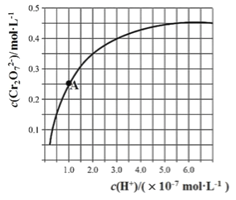
A.平衡时,pH越小,c(![]() )越大
)越大
B.A点CrO![]() 的平衡转化率为50%
的平衡转化率为50%
C.A点CrO![]() 转化为
转化为![]() 反应的平衡常数K=1014
反应的平衡常数K=1014
D.平衡时,若溶液中c(![]() )=c(
)=c(![]() ),则c(H+) > 2.0×10-7 mol·L-1
),则c(H+) > 2.0×10-7 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A.在pH = 1的溶液中:SO![]() 、Cl、NO
、Cl、NO![]() 、Na+
、Na+
B.在能使酚酞变红的溶液中:Na+、Cl、NO![]() 、K+
、K+
C.在1 mol·L-1的NaAlO2溶液中:K+、Ba2+、SO![]() 、OH
、OH
D.在1 mol·L-1的AlCl3溶液中:NH![]() 、Ag+、Na+、NO
、Ag+、Na+、NO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含有Al2O3、Fe2O3等杂质的铬铁矿[主要成分为Fe(CrO2)2]为主要原料生产重铬酸钠晶体(Na2Cr2O7·2H2O)的主要工艺流程如下:

已知:铬铁矿在空气中与纯碱煅烧生成Na2CrO4和一种红棕色固体,同时释放出CO2气体,且Al2O3+Na2CO3![]() 2NaAlO2+CO2↑。请回答:
2NaAlO2+CO2↑。请回答:
(1)在铬铁矿Fe(CrO2)2中,Cr的化合价为 。
(2)滤渣2的成分为 。
(3)将滤渣1放入稀硫酸溶解后得溶液W,检验该溶液中金属离子的方法是 。
(4)根据有关国家标准,含CrO![]() 的废水要经化学处理,使其浓度降至5.0×10-7 mol/L以下才能排放。含CrO
的废水要经化学处理,使其浓度降至5.0×10-7 mol/L以下才能排放。含CrO![]() 的废水处理通常用以下方法:还原法:
的废水处理通常用以下方法:还原法:![]() 。写出酸性条件下CrO
。写出酸性条件下CrO![]() 与绿矾(FeSO4.7H2O)在溶液中反应的离子方程式:____________________________。
与绿矾(FeSO4.7H2O)在溶液中反应的离子方程式:____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com