
 按图电解实验装置(都是惰性电极),若通直流电一段时间后,左池中溶液的pH上升,右池中溶液的pH下降,不仅a,b两电极放电离子的物质的量相等,且b,c两电极放电离子的物质的量也相等,则电解液应选用下表中的( )
按图电解实验装置(都是惰性电极),若通直流电一段时间后,左池中溶液的pH上升,右池中溶液的pH下降,不仅a,b两电极放电离子的物质的量相等,且b,c两电极放电离子的物质的量也相等,则电解液应选用下表中的( )| 选项 | 左池 | 右池 |
| A | KCl | Cu(NO3)2 |
| B | AgNO3 | CuSO4 |
| C | NaCl | AgNO3 |
| D | KOH | CuSO4 |
| A、A | B、B | C、C | D、D |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
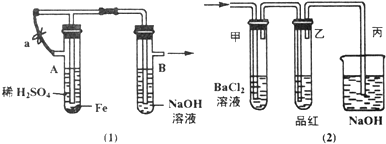
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

| ||
| 活性炭脱色 |
| 并保温 |
| 操作① |
| 蒸发浓缩 |
| 冷却晶体 |
| 操作② |
| 编号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准溶液的体积/mL | 18.02 | 17.98 | 18.00 | 20.03 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 理由 | 结论 |
| A | 与盐酸反应时,相同物质的量的原子失去电子的数目:Al>Na | 还原性:Al>Na |
| B | 室温时,相同物质的量浓度溶液的pH:AlCl3<MgCl2 | 碱性:Mg(OH)2>Al(OH)3 |
| C | 相同数目的分子可电离的H+数:H2SO4>HClO4 | 酸性:H2SO4>HClO4 |
| D | 用饱和NaHCO3溶液可以除去CO2 中含有的少量SO2 | 非金属性:S>C |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 用如图所示的收集装置收集氨气时,由于气流略强使得在试管底部形成气旋,导致氨气与空气混合而不能收集到纯氨气.现在有一小团棉花,请问将棉花放在试管那个位置可以阻止气旋?请说明理由.
用如图所示的收集装置收集氨气时,由于气流略强使得在试管底部形成气旋,导致氨气与空气混合而不能收集到纯氨气.现在有一小团棉花,请问将棉花放在试管那个位置可以阻止气旋?请说明理由.查看答案和解析>>
科目:高中化学 来源: 题型:
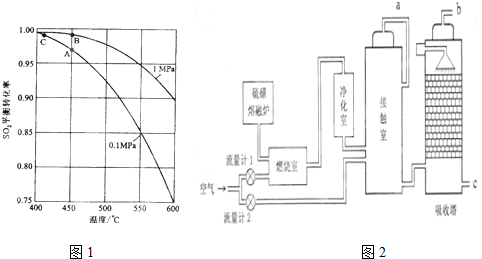
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、x值为2 |
| B、混合气体的密度增大 |
| C、平衡时N的浓度为0.6 mol/L |
| D、N的转化率为80% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、气体单质中一定含有共价键 |
| B、由非金属元素组成的化合物一定是共价化合物 |
| C、含有离子键的晶体一定是离子晶体 |
| D、一定是在发生化学反应时,化学键才发生断裂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com