

分析 银铜合金在空气中熔炼,渣料中含有氧化铜和少量银,加入稀硫酸,过滤后得到硫酸铜溶液,在硫酸铜溶液中加入硫酸铝和稀氢氧化钠溶液,煮沸、过滤得到Al(OH)3和CuO,煅烧可得到CuAlO2,滤渣含有Ag,粗银电解时,粗银为阳极,在阴极上得到银,可得到提纯的目的,
(1)渣料含有CuO,与稀硫酸反应生成硫酸铜和水;
(2)未煮沸之前是Cu(OH)2和Al(OH)3,Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃,煮沸后Cu(OH)2分解产生氧化铜;
(3)操作A用于分离固体和液体;
(4)m(Cu)=64%×5.0kg=3.2Kg=3200g,在CuAlO2中Cu、Al个数比为1:1,以此计算该题;
(5)由CuSO4溶液获得CuSO4•5H2O晶体,需要经过蒸发浓缩,冷却结晶(或结晶),过滤,洗涤和低温干燥等操作.
解答 解:(1)渣料含有CuO,与稀硫酸反应生成硫酸铜和水,反应的化学方程式为CuO+H2SO4=CuSO4+H2O,故答案为:CuO+H2SO4=CuSO4+H2O;
(2)未煮沸之前是Cu(OH)2和Al(OH)3,Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃,煮沸后Cu(OH)2分解产生氧化铜,可知A为Al(OH)3和CuO,故答案为:Al(OH)3;CuO;
(3)操作A用于分离固体和液体,为过滤操作,故答案为:过滤;
(4)m(Cu)=64%×5.0kg=3.2Kg=3200g,
n(Cu)=m÷M=3200g÷64g/mol=50mol,
则理论上5.0kg废料中的铜可完全转化为50mol CuAlO2,
由于在CuAlO2中Cu、Al个数比为1:1,
所以根据原子守恒可得:n[Al2(SO4)3]=$\frac{1}{2}$n(Al)=$\frac{1}{2}$n(Cu)=25mol,
n=$\frac{25mol}{1mol/L}$=25L,
故答案为:50;25;
(5)由CuSO4溶液获得CuSO4•5H2O晶体,需要经过蒸发浓缩,冷却结晶(或结晶),过滤,洗涤和低温干燥等操作,
故答案为:蒸发浓缩、冷却结晶.
点评 本题考查物质的制备,为高考常见题型,侧重于学生的分析、计算和实验能力的考查,注意把握物质的性质以及实验流程所给信息,结合质量守恒定律完成该题,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 平衡常数不变 | B. | n(O2)增大 | ||
| C. | SO2的体积分数增大 | D. | c(SO2)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
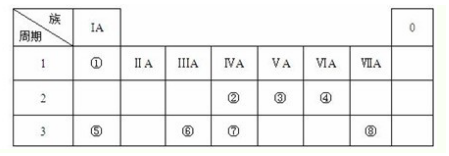
 或
或 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 表示硫的燃烧热的热化学方程式S(s)+$\frac{3}{2}$O2(g)=SO3(g);△H=-315 kJ/mol | |
| B. | 表示中和热的热化学方程式NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.3 kJ/mol | |
| C. | 表示H2燃烧热的热化学方程式H2(g)+$\frac{1}{2}$O2(g)=H2O(g);△H=-241.8 kJ/mol | |
| D. | 表示CO燃烧热的热化学方程式2CO(g)+O2(g)=2CO2(g);△H=-566 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3与过量NaOH溶液反应生成AlO2-,则与过量NH3•H2O反应也生成AlO2- | |
| B. | Al与Fe2O3能发生铝热反应,则与MnO2也能发生铝热反应 | |
| C. | Fe与Cl2反应生成FeCl3,则与I2反应可生成FeI3 | |
| D. | Na2O2与CO2反应生成Na2CO3和O2,则与SO2反应可生成Na2SO3和O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol NaHSO4 晶体中含阴阳离子总数是0.3NA | |
| B. | 6.2gNa2O溶入水配成1L溶液,所得溶液的物质的量浓度为0.2 mol/L | |
| C. | 11.2 L CO2和O3混合气体中含有的原子数是1.5 NA | |
| D. | 17 g H2O2完全分解,转移电子数是1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
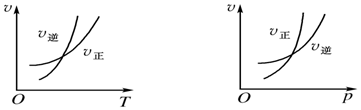
| A. | m>n,Q>0 | B. | m>n+p,Q>0 | C. | m>n,Q<0 | D. | m>n+p,Q>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com