
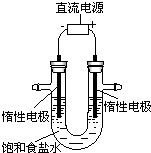
 电解饱和食盐水的装置如图所示,若收集的H2为2 L,则同样条件下收集Cl2小于2 L,原因是
电解饱和食盐水的装置如图所示,若收集的H2为2 L,则同样条件下收集Cl2小于2 L,原因是

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向蔗糖中加入浓硫酸后出现发黑现象,说明浓H2SO4具有脱水性 |
| B、浓硝酸在光照下颜色变黄,说明浓硝酸不稳定 |
| C、稀释浓硫酸时应将水沿着烧杯壁慢慢地注入盛有浓硫酸的烧杯中,并不断搅拌 |
| D、浓硫酸能与铜反应,说明浓硫酸有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CuS的溶解度大于PbS的溶解度 |
| B、原生铜的硫化物具有还原性,而铜蓝没有还原性 |
| C、CuSO4与ZnS反应的离子方程式是Cu2++ZnS→CuS+Zn2+ |
| D、整个过程涉及的反应类型只有氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲、乙、丙、丁四种物质转化关系如图.已知甲是一种导致钢铁生锈及许多还原性物质变质的单质,化合物乙、丙、丁均含有第三周期一种相同元素R.
甲、乙、丙、丁四种物质转化关系如图.已知甲是一种导致钢铁生锈及许多还原性物质变质的单质,化合物乙、丙、丁均含有第三周期一种相同元素R.| 温度/℃ | 400 | 450 | 500 | 550 | 600 | 650 |
| 转化率/% | 99.2 | 97.5 | 93.5 | 85.6 | 73.7 | 58.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com