
X、Y、Z、W四种短周期元素在元素周期表的位置如图。其中W的原子序数是Y的2倍。

(1)W离子的结构示意图为____________。
(2)X的最简单氢化物与Cl2发生取代反应的化学方程式为(写一个)________________。
(3)能证明X、Z两元素非金属性强弱的离子方程式为__________________________。
(4)一定条件下,在密闭容器中,充入一定量的XY2(g)和XY (g),发生反应:
WY2(g)+2XY(g)  2XY2 (g)+W(1)。T1oC时,各物质的平衡浓度如下表:
2XY2 (g)+W(1)。T1oC时,各物质的平衡浓度如下表:

②若温度升高到T2oC时,反应的平衡常数为6.64,则该反应的正反应为_______反应(填 “吸热”或“放热”)。
(5)① 25℃、101 kPa,l mol金属镁完全燃烧放出300.0 kJ热量,1 mol单质X完全燃烧放出393.5 kJ热量。金属镁与X的最高价氧化物反应的热化学方程式为_________。
②室温下,Mg(OH) 2饱和溶液_________(填“能”或“不能”)使酚酞试液变红,通过计算说明原因(已知:Ksp[Mg(OH) 2]=4.0×10-12)。答__________________________
(1)
(2)CH4 + Cl2 →? CH3Cl+HCl
(3)CO2+SiO32-+H2O= CO32-+H2SiO3↓
(4)吸热
(5)2Mg(s)+ CO2(g) = 2MgO(s)+C(s) △H=-206.5kJ/mol
(6)能??? Ksp[Mg(OH)2]=4.0×10-12=c(Mg2+)×c2(OH-)??
1/2c3(OH-)= 4.0×10-12
c(OH-) =2.0×10-4
pOH=3.7??
pH=14-3.7=10.3?
酚酞的变色范围为8.2——10,故变红。
【解析】
试题分析:W、Y同主族,且W的原子序数是Y的2倍,只有O、S符合,X、Y、Z、W分别为C、O、Si、S。(2)X的最简单氢化物为甲烷,甲烷与氯气发生取代反应,生成CH3Cl、CH2Cl2、CHCl3、CCl4;(3)比较元素非金属性强弱可以根据最高价氧化物对应水化物酸性、与氢气化合的能力、氢化物稳定性及单质的置换反应;能证明X、Z两元素非金属性强弱的反应可以从强酸制弱酸和常温条件下的单质置换反应处理,本题可根据碳酸生成硅酸得出结论;
(4)该条件下平衡常数k=c2(XY2)/ c2(XY) c(WY2)=4.44<6.64,升高温度平衡正向移动,反应吸热;
(5)①Mg(s)+1/2O2(g)= MgO(s) △H=-300.0 kJ/mol
②C(s)+O2(g)= CO2(g) △H=-393.5 kJ/mol
①×2-②得出2Mg(s)+ CO2(g) = 2MgO(s)+C(s) △H=-206.5kJ/mol
②Ksp[Mg(OH)2]=4.0×10-12=c(Mg2+)×c2(OH-)?? 1/2c3(OH-)= 4.0×10-12? c(OH-) =2.0×10-4
pOH=3.7??? pH=14-3.7=10.3? 酚酞的变色范围为8.2——10,故变红。
考点:考查化学综合涉及原子结构、周期律、平衡移动、热化学、溶度积计算等有关问题。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
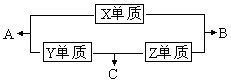 X、Y、Z、W四种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化:
X、Y、Z、W四种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化:
| ||
| △ |
| ||
| △ |
| ||
| ||
| △ |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
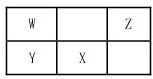 有X、Y、Z、W四种短周期元素的位置关系如图所示,已知W为该族中半径最小的元素,Z为该周期中原子半径最小的元素.
有X、Y、Z、W四种短周期元素的位置关系如图所示,已知W为该族中半径最小的元素,Z为该周期中原子半径最小的元素.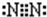
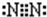
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y |
| Z | W |
| A、W的原子序数可能是Y的原子序数的2倍 |
| B、Z元素的原子半径可能比Y元素的小 |
| C、W的气态氢化物的稳定性一定比Y的强 |
| D、若Z的最高正价为+m,则X的最高正价也一定为+m |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com