
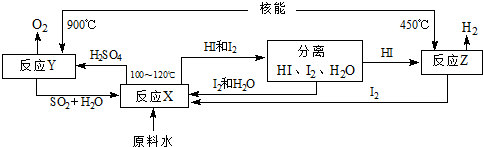
分析 (1)只要能减少自然资源的运用都属于“开源节流”;
(2)最节能的方法是运用太阳能;
(3)第二步MnFe2O4-X和水反应生成MnFe2O4和氢气;
(4)在100-120℃条件下,碘、二氧化硫和水反应生成硫酸和氢碘酸;根据流程图判断能循环使用的物质;根据水和氢气的关系式计算生成的氢气的量.
解答 解:(1)只要能减少自然资源的运用都属于“开源节流”.
a、不能减少自然资源的运用,故错误.
b、c、d能减少自然资源的运用,故正确.
故答案为:bcd;
(2)最节能的方法是运用太阳能,高温、电解都需要其它自然资源,故答案为:C;
(3)第二步MnFe2O4-X和水反应生成MnFe2O4和氢气,反应方程式为MnFe2O4-X+xH20=MnFe2O4+xH2↑,故答案为:MnFe2O4-X+xH20=MnFe2O4+xH2↑;
(4)在100-120℃条件下,碘、二氧化硫和水反应生成硫酸和氢碘酸,反应方程式为SO2+I2+2H2O=2HI+H2SO4;根据流程图知,该流程中循环使用的原料有SO2、I2;一个H2O中含有2个氢原子,所以水分子和氢分子的个数之比是1:1,故从理论上讲,该流程中,1mol原料水制得1mol氢气,
故答案为:SO2+I2+2H2O=2HI+H2SO4;SO2、I2;1.
点评 本题考查较为综合,为高考常见题型和高频考点,题目涉及化学反应与能量、能源的综合利用等知识,侧重于化学与生活、生产的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度中等.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32种 | B. | 36种 | C. | 64种 | D. | 72种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=-485 kJ•mol-1 | B. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=485 kJ•mol-1 | ||
| C. | 2H2(g)+O2(g)═2H2O(g)△H=485 kJ•mol-1 | D. | 2H2(g)+O2(g)═2H2O(g)△H=-485 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
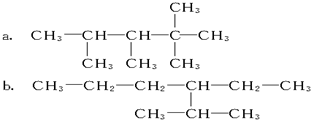
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
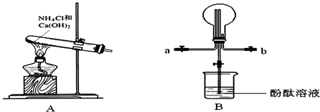
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
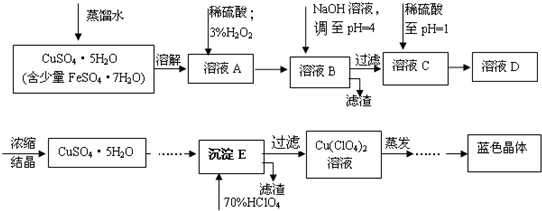
| 离子 | 溶液pH值 | |
| 开始沉淀 | 沉淀完全 | |
| Fe2+ | 7.6 | 9.6 |
| Fe3+ | 2.7 | 3.7 |
| Cu2+ | 5.2 | 6.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com