
| A. | NH4HSO3溶液与足量NaOH溶液共热:NH4++HSO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$ NH3↑+SO32-+2H2O | |
| B. | 向氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | 用盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2 MnO4-+6H++5H2O2═2Mn2++5 O2↑+8H2O | |
| D. | 用石墨电极电解饱和MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH- |
分析 A.反应生成亚硫酸铵、氨气、水;
B.反应生成氢氧化铝和氯化铵;
C.高锰酸钾可氧化盐酸;
D.电解生成氢氧化镁、氢气、氯气.
解答 解:A.NH4HSO3溶液与足量NaOH溶液共热的离子反应为NH4++HSO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$ NH3↑+SO32-+2H2O,故A正确;
B.向氯化铝溶液中加入过量氨水的离子反应为Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故B错误;
C.高锰酸钾可氧化盐酸,不能证明H2O2具有还原性,故C错误;
D.用石墨电极电解饱和MgCl2溶液的离子反应为Mg2++2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+Mg(OH)2↓,故D错误;
故选A.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、与量有关的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题

| A. | 该固体粉末中一定不含有BaCl2 | |
| B. | 该固体粉末中一定含有KNO3 | |
| C. | 它的组成可能是CaCO3、BaCl2、CuSO4 | |
| D. | 它的组成一定是CaCO3、Na2SO4、KNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
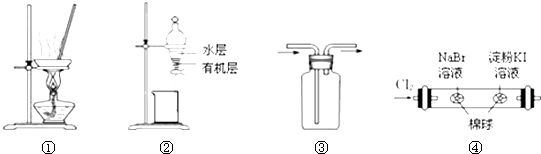
| A. | 用图①所示装置,蒸干NH4Cl饱和溶液制备NH4Cl晶体 | |
| B. | 用图②所示装置,分离CCl4萃取碘水后的有机层和水层 | |
| C. | 按装置③所示的气流方向可用于收集H2、NH3等 | |
| D. | 用图④所示装置,可以证明氧化性:Cl2>Br2>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知室温下,某些弱酸的电离常数如下:
已知室温下,某些弱酸的电离常数如下:| CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | 1.7×10-5 | Ka1=4.2.×10-7 Ka2=5.6.×10-11 | 3×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,16gCH4含有10NA个电子 | |
| B. | 0.1mol•L-1的盐酸溶液中含有0.1NA个H+ | |
| C. | 1molNa与乙醇完全反应,失去2NA个电子 | |
| D. | 标准状况下,22.4L苯含有NA个苯分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、c molCH3OH(g)、c molH2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com