
【题目】太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质。
(1)基态铜原子的电子排布式为_____________;已知高温下CuO![]() Cu2O+O2,从铜原子价层电子结构(3d和4s轨道上应填充的电子数)变化角度来看,能生成Cu2O的原因是___________________________。
Cu2O+O2,从铜原子价层电子结构(3d和4s轨道上应填充的电子数)变化角度来看,能生成Cu2O的原因是___________________________。
(2)硒、硅均能与氢元素形成气态氢化物,则它们形成的最简单的氢化物中,分子构型分别为____________, 若“Si-H”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se____Si (填“>”、“<”)。人们把硅与氢元素形成的一类化合物叫硅烷。硅烷的组成、结构与相应的烷烃相似,硅烷的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是_____________________________________________。

(3)与铟、镓元素处于同一主族的硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤电子对的分子或离子生成配合物,如BF3能与NH3反应生成BF3·NH3。BF3·NH3中B原子的杂化轨道类型为______, B与N之间形成___________键。
(4)金刚砂(SiC)的硬度为9.5,其晶胞结构如下图所示,则金刚砂晶体类型为_________________,在SiC中,每个C原子周围最近的C原子数目为___个;若晶胞的边长为a pm,则金刚砂的密度为____g/cm3 (用NA表示阿伏伽德罗常数的值)。

【答案】 1s22s22p63s23p63d104s1或[Ar]3d104s1 CuO中铜的价层电子排布为3d9,Cu2O中铜的价层电子排布为3d10,后者处于稳定的全充满状态而前者不是,因而二价铜能在一定条件下转化为更稳定的一价铜 V形 正四面体形 > 硅烷为分子晶体,随相对分子质量增大,分子间作用力增强,熔沸点升高 sp3杂化 配位 原子晶体 12 1.6×1032/ (a3·NA)
【解析】分析:(1)原子核外电子排布决定着元素的稳定性,特别是全满、半满和全空比较稳定,因此通过铜原子的核外电子排布可解答;(2)根据已知物质H2O和CH4的分子结构可推知H2Se和SiH4的分子结构,电负性简单理解就是原子吸引电子的能力,结构相似的物质,其熔沸点可通过分子间作用力大小去判断;(3)BF3与NH3以配位键结合成化合物BF3·NH3时,B元素要形成四个键,所以只能以sp3杂化;(4)根据金刚石的晶体结构可推测SiC的晶体结构,通过晶胞中含有的原子数和晶胞的边长,可计算出晶胞的密度。
详解:(1)已知铜的原子序数为29,其原子核外电子排布为1s22s22p63s23p63d104s1或[Ar]3d104s1;CuO中铜是+2价,价电子排布为3d9,而Cu2O中铜是+1价,价电子排布为3d10,后者处于稳定的全充满状态而前者不是,因此CuO能在一定条件下转化为更稳定的Cu2O。
(2)由于O与Se同族,C与Si同族,它们形成的最简单的氢化物中,H2O分子是V型结构,则H2Se也是V型结构,CH4是正四面体结构,可知SiH4也是正四面体结构;在Si-H中共用电子对偏向氢元素,即氢的电负性>硅,氢气与硒反应时单质硒是氧化剂,则硒吸引电子能力>氢,所以电负性 Se>Si;由图象可知,在一系列硅烷中,随相对分子质量的增大,分子间作用力增强,所以熔沸点升高。
(3)B元素最外层只有3个电子,但有4个轨道,所以可与具有孤电子对的分子或离子以配位键形成配合物,因此在配合物BF3·NH3中B原子的杂化轨道类型为sp3杂化,在B和N之间形成配位键。
(4) 金刚砂晶体是由C原子和Si原子形成的原子晶体,在该晶胞中含有的C=4,Si= ![]() =4,即含有4个SiC,该晶胞为面心立方,且C和Si可以互换,每两个C原子间最近的距离为面对角线的一半,所以每个C周围距离最近的C原子有
=4,即含有4个SiC,该晶胞为面心立方,且C和Si可以互换,每两个C原子间最近的距离为面对角线的一半,所以每个C周围距离最近的C原子有![]() =12个,已知晶胞的边长为a pm,即a×10-10cm,其体积为a3×10-30cm3,质量为
=12个,已知晶胞的边长为a pm,即a×10-10cm,其体积为a3×10-30cm3,质量为![]() g,则金刚砂的密度为
g,则金刚砂的密度为![]() g/cm3。
g/cm3。


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
【题目】实验室在500℃时,隔绝空气加热硫酸亚铁铵[(NH4)2Fe(SO4)2]至分解完全并确定分解产物成分的装置如图所示(已知分解的固体产物可能有FeO、Fe2O3和Fe3O4,气体产物可能有NH3、N2、H2O、SO3和SO2)。下列说法正确的是

A. 取①中固体残留物与稀硫酸反应并滴加KSCN,溶液变红,则残留物一定为Fe2O3
B. 装置②用于检验分解产物中是否有水蒸气生成,试剂X最好选用碱石灰
C. 装置③用于检验分解产物中是否有SO3气体生成并除去SO3和NH3
D. 装置④用于检验分解产物中是否有SO2气体生成,装置⑤用于收集生成的NH3和N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A. 10mL0.1mol·L-1Na2CO3溶液逐滴滴加到10mL0.1mol·L-1盐酸中,混合溶液中各离子浓度的大小关系:c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-)
B. NH4HCO3溶液中存在:C(NH4+)=C(HCO3-)+C(CO32-)+C(H2CO3)
C. 常温下,测得某纯CaSO3与水形成的浊液pH为9,已知Ka1(H2SO3)=1.8×10-2,Ka2(H2SO3)=6.0×10-9,忽略SO32-的第二步水解,则Ksp(CaSO3)=3.6×10-10
D. 若两种盐溶液的浓度相同且pH(NaX)>pH(NaY),则c(X-)+c(OH-)<c(Y-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为元素周期表短周期的一部分,Z原子的电子层数为n,最外层电子数为2n+1。下列叙述错误的是 ( )

A. 氢和R、W三种元素形成的阴离子有3种以上
B. RY2分子中每个原子的最外层均为8电子结构
C. R、Y、Z的最高价氧化物对应水化物的酸性依次增强
D. X、Z的氢化物的热稳定性和还原性,都依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某地空气中SO2和可吸入颗粒的含量,某同学设计了如下图所示的实验装置:

注:气体流速管是用来测量单位时间内通过气体体积的装置
(1)上述实验测定原理为_________________________________ (用化学方程式表示)。
(2)应用上述装置测定空气中SO2和可吸入颗粒的含量,除需测定气体流速(单位:mL·s-1)外,还需要测定碘溶液蓝色褪去所需的时间和___________________________。
(3)己知:碘单质微溶于水,KI可以增大碘在水中溶解度。为精确配制100 mL 5.0×10-4mol·L-1的碘溶液,先要配制1000 mL 1.0×10-2mol·L-1碘溶液,再取5.00 mL溶液稀释成为5.0×10-4mol·L-1碘溶液。
①第一步:用托盘天平称取___ g 碘单质加入烧杯中,同时加入少量碘化钾固体,加适量水搅拌使之完全溶解。
②第二步:________________,洗涤、定容、摇匀。
③第三步:用第二步所得溶液配制5.0×10-4mol·L-1碘溶液,此步操作中,除烧杯、玻璃棒、胶头滴管外还需要的玻璃仪器有________________________。
(4)空气中SO2含量的测定:
①已知空气中二氧化硫的最大允许排放浓度不得超过0.02mg·L-1,在指定的地点取样,以200mL·s-1气体流速通过气体流速管通入到上图实验装置中,观察记录碘溶液褪色所需时间为500s,则该地空气中的SO2含量是________ mg·L-1,____________(填“符合”、“不符合”)排放标准。
②如果甲同学用该方法测量空气中SO2的含量时,所测得的数值比实际含量低,其原因可能是________________________________(假设溶液配制、称量或量取及各种读数均无错误。写出一种可能原因即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z和W代表原子序数依次增大的四种短周期主族元素。它们满足以下条件:①在元素周期表中,Y、Z、W的位置如图所示,且Y、Z、W三种元素的原子最外层电子数之和为17;②X、Y、W分别位于不同周期。下列说法正确的是

A. 四种元素的原子半径大小顺序为W>Y>X>Z
B. Z、W元素的最简单氢化物的沸点为H2Z<H2W
C. X、Y、Z既能形成离子化合物,又能形成共价化合物
D. X分别与Y、Z之间形成的核外电子总数为10的微粒只有YX3和X2Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源、资源问题是当前人类社会面临的一项重大课题。
(1)直接利用物质燃烧提供热能在当今社会仍然占很大比重,但存在利用率低的问题。CH4、H2、CO、CH3OH都是重要的能源物质,甲烷燃烧的化学方程式为:____。
(2)燃料电池将能量转化效率比直接燃烧效率高,如图为某种燃料电池的工作原理示意图,a、b均为惰性电极。

①使用时,空气从____口通入(填“A”或“B”);
②假设使用的“燃料”是甲醇,a极的电极反应式为:____。
(3)钢铁的腐蚀现象非常普遍,电化学腐蚀是造成钢铁腐蚀的主要原因,某同学按下图进行钢铁腐蚀的模拟,则正极的电极反应式为:____,当导线中有3.01×1023个电子流过,被腐蚀的铁元素为____g。[ 提示:电化学的总反应式为2Fe+2H2O+O2=2Fe(OH)2]

(4)海水化学资源的开发利用具有重要的意义和作用,下图是海带中提取碘的示意图:

①中操作的名称是____;反应②的离子方程式是____,下述物质中不可做试剂③的是____。
A.乙醇 B.苯 C.乙酸 D.四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向25mL0.1mol/LNaOH溶液中逐滴加入0.2mol/L醋酸溶液,曲线如下图所示。下列有关溶液中粒子浓度关系的描述中,错误的是( )
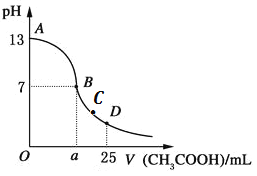
A. 在A、B间可能存在:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B. 在B点:a =12.5,且有c(Na+)=c(CH3COO-)
C. 在C点:c(CH3COO-) > c(Na+) >c(H+)>c(OH-)
D. 在D点:c(CH3COO-) + c(CH3COOH) = 2c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用苯和1,2—二氯乙烷制联苄的反应原理如下
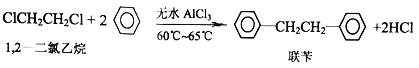
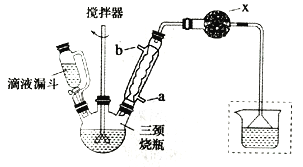
实验室制取联苄的装置如图所示(加热和夹持仪器略去)
实验步骤:
①在三颈烧瓶中加入120.0mL苯和适量无水AlCl3,由滴液漏斗滴加10.0mL 1,2-二氯乙烷,控制反应温度在60~65℃,反应约60min。
②将反应后的混合物依次用2%Na2CO3溶液和水洗涤,在所得产物中加入少量无水MgSO4固体,静置、过滤,蒸馏收集一定温度下的馏分,得联苄18.2g。
相关物理常数和物理性质如下表:
名称 | 相对分子质量 | 密度/g·cm-3 | 熔点/℃ | 沸点/℃ | 溶解性 |
苯 | 78 | 0.88 | 5.5 | 80.1 | 难溶于水,易溶于乙醇 |
1,2-二氯乙烷 | 99 | 1.27 | -35.3 | 83.5 | 难溶于水,可溶于苯 |
联苄 | 182 | 0.98 | 52 | 284 | 难溶于水,易溶于苯 |
(1)和普通分液漏斗相比,使用滴液漏斗的优点是_______________________;球形冷凝管进水口是____________(选填“a”或“b”)
(2)仪器X的名称是________________;装置中虚线部分的作用是____________。
(3)洗涤操作中,用2%Na2CO3溶液洗涤的目的是___________;水洗的目的是____________。
(4)在进行蒸馏操作时,应收集____________℃的馏分。
(5)该实验中,联苄的产率约为____________%(小数点后保留两位)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com