
室温下,在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH-浓度分别为a mol·L-1与b mol·L-1,则a和b的关系为( )
A.a>b B.a=10-4b C.b=10-4a D.a=b
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A.在标况下,11.2 L NO与11.2 L O2混合后所含分子数为0.75NA
B.常温常压下,16 g O3所含的电子数为8NA
C.0.1 mol Na2O2晶体中含有0.4NA个离子
D.铝跟氢氧化钠溶液反应生成1 mol氢气时,转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
能说明BF3分子中的4个原子处于同一平面的理由是( )
A.3个B—F的键能相同 B.3个B—F的键长相同
C.3个B—F的键角均为120° D.3个B—F的键均为σ键
查看答案和解析>>
科目:高中化学 来源: 题型:
不能用化学平衡移动原理说明的事实是( )
A.合成氨在高压下进行是有利的
B.温度过高对合成氨不利
C.使用催化剂能使合成氨速率加快
D.及时分离从合成塔中出来的混合气,有利于合成氨
查看答案和解析>>
科目:高中化学 来源: 题型:
恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器内,发生如下反应N2+3H2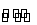 2NH3。
2NH3。
(1)若反应到某时刻t时,n(N2)=13 mol, n(NH3)=6 mol,a=_______。
(2)反应到达平衡时,混合气体体积为716.8 L(标准状况)其中NH3的含量(体积分数)为25%,计算平衡时NH3的物质的量_________。
(3)混合气体中a∶b=_________。
(4)平衡混合气体中n(N2)∶n(H2)∶n(NH3)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关盐类水解的说法不正确的是( )
A.盐类水解过程破坏了纯水的电离平衡 B.盐类水解反应是酸碱中和反应的逆反应
C.盐类水解的结果使溶液不一定呈中性 D.Na2S溶液中c(Na+)是c(S2-)的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液、NaHSO4溶液和BaCl2溶液中的一种,已知A、B溶液的pH相同,A、C混合后溶液变浑浊。下列说法正确的是( )
A.D溶液的pH<7 B.C溶液中的溶质溶于水促进了水的电离
C.溶液A滴入到碳酸氢钠溶液中产生气体 D.溶液B进行焰色反应呈黄色
查看答案和解析>>
科目:高中化学 来源: 题型:

某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(1)请完成以下实验设计表(表中不要留空格):
| 编号 | 实验目的 | 碳粉/g | 铁粉/g | 醋酸/% |
| ① | 为以下实验作参照 | 0.5 | 2.0 | 90.0 |
| ② | 醋酸浓度的影响 | 0.5 | 36.0 | |
| ③ | 0.2 | 2.0 | 90.0 |
(2)编号①实验测得容器中压强随时间变化如图2。t2时,容器中压强明显小于起始压强,其原因是铁发生了________腐蚀,请在图3中用箭头标出发生该腐蚀时电子流动方向;此时,碳粉表面发生了________(填“氧化”或“还原”)反应,其电极反应式是______________________________。

(3)该小组对图2中0~t1时压强变大的原因提出了如下假设,请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二:________________________________________________________________________;
……
(4)为验证假设一,某同学设计了检验收集的气体中是否含有H2的方案。请你再设计一个实验方案验证假设一,写出实验步骤和结论。
| 实验步骤和结论(不要求写具体操作过程): |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com