
【题目】铝是当前应用最广泛的金属材料之一,铝制品及其化合物在日常生活和工农业生产中也有着重要的用途。回答下列问题:
(1)基态铝原子的核外电子排布式为____________。
(2)根据元素周期律等知识判断,第一电离能Al____________Mg(填写“大于”或“小于”)。
(3)Al2O3是常用的耐火材料,工业上也是用电解Al2O3方法制取金属Al,据此判断Al2O3的晶体类型是____________。
(4)LiAlH4是一种重要的有机合成试剂,AlH4-的立体构型为____________,LiAlH4中Al原子的杂化轨道类型为____________。
(5)金属铝的晶胞结构如图1所示,原子之间相对位置关系的平面图如图2所示。

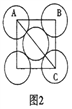
①晶体铝中原子的堆积方式为____________。
②已知铝原子半径为acm,摩尔质量为Mg·mol-1,阿伏加德罗常数的值为NA,则晶体铝的密度ρ=_______g·cm-3(用含a、M、NA的代数式来表示)。
【答案】 1s22s22p63s23p1 小于 离子晶体 正四面体 sp3 面心立方 ![]()
【解析】试题分析:本题考查物质结构与性质,主要考查核外电子排布式的书写,第一电离能的比较,空间构型和杂化方式的判断,晶体类型的判断,金属晶体的堆积方式,晶胞的计算。
(1)Al的原子序数为13,基态Al原子核外有13个电子,根据构造原理,基态铝原子的核外电子排布式为1s22s22p63s23p1。
(2)Al的价电子排布式为3s23p1,Mg的价电子排布式为3s2,Mg的3s处于全充满,较稳定;第一电离能:Al小于Mg。
(3)工业上用电解Al2O3方法制取金属Al,说明熔融Al2O3能导电,Al2O3属于离子晶体。
(4)AlH4-中中心原子Al的孤电子对数为![]() (3+1-4
(3+1-4![]() 1)=0,Al的价层电子对数为0+4=4,AlH4-的VSEPR模型为正四面体型,由于Al上没有孤电子对,AlH4-的立体构型为正四面体型。中心原子Al原子采取sp3杂化。
1)=0,Al的价层电子对数为0+4=4,AlH4-的VSEPR模型为正四面体型,由于Al上没有孤电子对,AlH4-的立体构型为正四面体型。中心原子Al原子采取sp3杂化。
(5)①根据铝的晶胞结构知,晶体Al中原子的堆积方式为面心立方。
②铝原子半径为acm,根据原子间相对位置关系的平面图,晶胞的边长为![]() =2
=2![]() acm,晶胞的体积为(2
acm,晶胞的体积为(2![]() acm)3=16
acm)3=16![]() a3cm3,用“均摊法”,1个晶胞中含Al:8
a3cm3,用“均摊法”,1个晶胞中含Al:8![]() +6
+6![]() =4,1mol晶体的体积为
=4,1mol晶体的体积为![]() cm3NA=4
cm3NA=4![]() a3NAcm3,1mol晶体的质量为Mg,晶体铝的密度ρ=Mg
a3NAcm3,1mol晶体的质量为Mg,晶体铝的密度ρ=Mg![]() (4
(4![]() a3NAcm3)=
a3NAcm3)=![]() g/cm3。
g/cm3。


科目:高中化学 来源: 题型:
【题目】I.氢化钙是固体登山运动员常用的能源提供剂.某兴趣小组拟选用如下装置制备氢化钙.
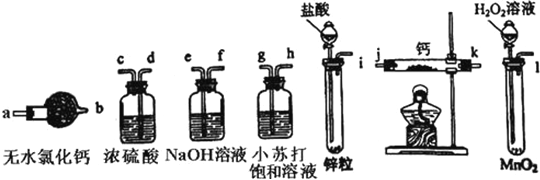
请回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为__________(填仪器接口的字母编号)
(2)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞_________(请按正确的顺序填入下列步骤的标号).
A.加热反应一段时间 B.收集气体并检验其纯度
C.关闭分液漏斗活塞 D.停止加热,充分冷却
(3)已知钙与氢化钙固体在外观上相似,现设计一个实验,用化学方法区分钙与氢化钙,请完善以下实验的简要步骤及观察到的现象:取适量氢化钙,在加热条件下与________反应,将反应气相产物通过装有_______的容器,观察到容器内固体颜色变化为________;取钙做类似实验,观察不到类似的反应现象.
II.某化学兴趣小组发现,往CuSO4溶液中加入一定浓度的Na2CO3溶液得到的蓝色沉淀,若加入NaOH溶液则得到浅绿色沉淀。为此,小组同学对蓝色沉淀成份作了如下探究:
该小组同学利用下列装置通过实验测定其组成
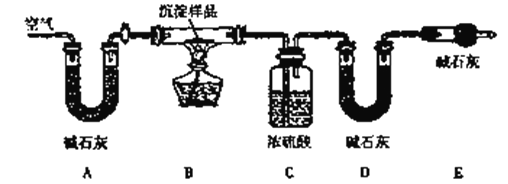
(1)检查装置气密性并装好药品后,点燃酒精灯前应进行的操作是______________。
(2)通过查找资料得知,该浅绿色沉淀物可能是溶解度最小的碱式硫酸铜(化学式CuSO4·3Cu(OH)2)。请你设计一个实验,证明浊液中的浅绿色沉淀物中是否含有硫酸根离子的方法__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有Al、C12、Al2O3、HCl(aq)、Al(OH)3、NaOH(aq)六种物质,它们之间有如图所示转化关系,图中每条线两端的物质之间都可以发生反应,下列推断不合理的是( )
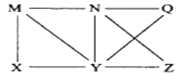
A. N一定是HCl(aq) B. X可能为Al或C12
C. Y一定为NaOH(aq) D. Q、Z中的一种必定为Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁是一种新型高效的无机高分子絮凝剂。用硫酸亚铁晶体及硫酸为原料催化氧化法生成硫酸铁,再水解、聚合成产品。实验室模拟生产过程如下:
![]()
已知Fe3+能水解成氢氧化铁:Fe3++3H2O===Fe(OH)3+3H+,为了防止Fe3+水解需加入硫酸。
(1)①用原料配制2.50 moL·L-1的硫酸亚铁溶液时用到的定量仪器有_________________。
②写出氧化过程中的离子方程式:________。
(2)综合考虑实际投料硫酸亚铁与硫酸的物质的量之比为1/1.25左右最佳,加入的硫酸比理论值稍多,但不能过多的原因是__________________________________。
(3)硫酸铁溶液水解可以得到一系列具有净水作用的碱式硫酸铁(xFe2O3·ySO3·zH2O),现采用重量法测定x、y、z的值。
①测定时所需的试剂是______(填选项序号)。
A.NaOH B. Ba(OH)2
C.BaCl2D.FeSO4
②需要测定________和__________的质量(填写化合物的化学式)。
(4)选出测定过程中所需的基本操作(按操作先后顺序列出) ______________(填序号)。
①过滤、洗涤 ②蒸发、结晶 ③萃取、分液 ④冷却、称量 ⑤烘干或灼烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A(C3H6)是基本有机化工原料。由A制备聚合物C和![]() 的合成路线(部分反应条件略去)如图所示。
的合成路线(部分反应条件略去)如图所示。
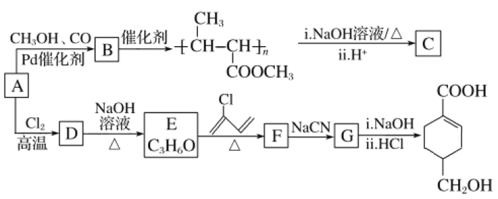
已知:![]() +‖
+‖![]()
![]() ;R—C≡N
;R—C≡N![]() R—COOH
R—COOH
回答下列问题:
(1)A的名称是______________,B含有的官能团的名称是________________(写名称)。
(2)C的结构简式为________________,D→E的反应类型为_____________。
(3)E→F的化学方程式为_____________________________________________________。
(4)![]() 中最多有________个原子共平面。
中最多有________个原子共平面。
(5)B的同分异构体中,与B具有相同的官能团且能发生银镜反应的共有________种;其中核磁共振氢谱为3组峰,且峰面积之比为6∶1∶1的是_____________________(写结构简式)。
(6)结合题给信息,以乙烯、HBr为起始原料制备丙酸,设计合成路线(其他试剂任选) ______。合成路线流程图示例:CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素a、b、c、d的原子序数依次增大,这四种元素形成的单质依次为m、n、p、q;x、y、z是由这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一;25℃时,0.01mol·L-lw溶液中,![]() =1.0×10-10。上述物质的转化关系如图所示,下列说法正确的是
=1.0×10-10。上述物质的转化关系如图所示,下列说法正确的是
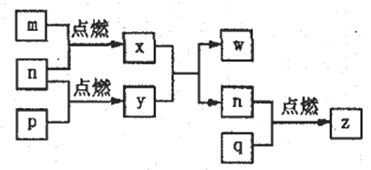
A. 原子半径的大小:a<b<c<d
B. 简单氢化物的沸点:b>d
C. y的电子式:![]()
D. y、w含有的化学键类型完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟甲香豆素是一种治疗胆结石的药物。合成其的两种中间体及羟甲香豆素的结构如下:
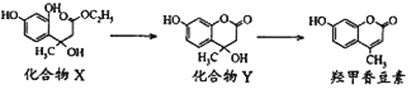
下列有关说法正确的是
A. 化合物X和Y分子各含有2个手性碳原子
B. 化合物Y能发生加成反应、取代反应和消去反应
C. lmol 羟甲香豆素最多可与2moINaOH反应
D. 化合物X和羟甲香豆素分别与溴水反应,最多消耗的Br2的物质的量之比为1:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com