
| A. | Na2CO3+CaCl2═CaCO3↓+2NaCl | B. | 3Fe+4H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2 | ||
| C. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O | D. | CaO+H2O═Ca(OH)2 |
分析 反应中存在元素化合价变化的反应为氧化还原反应,根据各选项中元素是否存在化合价变化进行判断,注意置换反应一定为氧化还原反应,而复分解反应一定不属于氧化还原反应.
解答 解:A.Na2CO3+CaCl2═CaCO3↓+2NaCl为复分解反应,反应中不存在化合价变化,不属于氧化还原反应,故A错误;
B.3Fe+4H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2为置换反应,存在化合价变化,一定属于氧化还原反应,故B正确;
C.2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O为分解反应,反应中不存在化合价变化,不属于氧化还原反应,故C错误;
D.CaO+H2O═Ca(OH)2为化合反应,反应中不存在化合价变化,不属于氧化还原反应,故D错误;
故选B.
点评 本题考查了氧化还原反应的判断,题目难度不大,明确氧化还原反应的特征解答关键,根据元素化合价是否变化来判断即可,试题培养了学生的分析能力及灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 100mL1mol/L的盐酸中含HCl分子数为0.1NA | |
| B. | 7.8gNa2O2和Na2S的混合物中阴离子数目为0.2NA | |
| C. | 标准状况下,2.24L SO3中含有氧原子数目为0.3NA | |
| D. | 2gD216O中含中子、质子、电子数目均为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然橡胶、聚氯乙烯的链节中均含有两种官能团 | |
| B. | 氯气易液化,可用钢瓶储存液氯 | |
| C. | 工业酒精的浓度通常为95% | |
| D. | 向某溶液加入CCl4,若CCl4层显橙红色,证明原溶液中存在Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
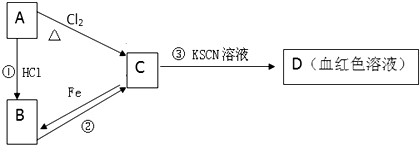
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-电离的离子方程式:HCO3-+H2O?CO32-+H3O+ | |
| B. | 漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3- | |
| C. | 过量的CO2通入NaOH溶液中:CO2-+2OH-=CO32-+H2O | |
| D. | 新制氢氧化铜(碱性)和乙醛反应:CH3CHO+2Cu(OH)2 $\stackrel{△}{→}$ CH3COOH+Cu2O↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化物:NO、CO2、SO2、Na2O2 | |
| B. | 碱:NaOH、KOH、Ca(OH)2、Na2CO3 | |
| C. | 铵盐:NH4Cl、NH4NO3、NH4HCO3、NH3•H2O | |
| D. | 碱性氧化物:Na2O、CaO、Al2O3、Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
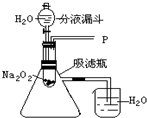 水能灭火也可以引火.把少量过氧化钠(Na2O2)粉末用干燥脱脂棉包裹(脱脂棉和过氧化钠不反应),将少量水滴到包有过氧化钠的脱脂棉上,则脱脂棉迅速发生燃烧.小明对此现象很感兴趣,于是他和同学们进行如下探究:
水能灭火也可以引火.把少量过氧化钠(Na2O2)粉末用干燥脱脂棉包裹(脱脂棉和过氧化钠不反应),将少量水滴到包有过氧化钠的脱脂棉上,则脱脂棉迅速发生燃烧.小明对此现象很感兴趣,于是他和同学们进行如下探究:| 实验步骤 | 实验现象 | 实验结论 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com