
| A、10 mL质量分数为98%的H2SO4,用水稀释至100 mL,H2SO4的质量分数为9.8% |
| B、在H2O2+Cl2=2HCl+O2反应中,每生成32 g氧气,则转移2 NA个电子 |
| C、标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g |
| D、一定温度下,1 L 0.50 mol?L-1NH4Cl溶液与2 L 0.25mol?L-1NH4Cl溶液含NH4+物质的量不同 |
| m |
| M |
| 32g |
| 16g/mol |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
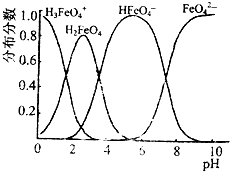 高铁酸钠的化学式为Na2FeO4,按要求回答下列问题:
高铁酸钠的化学式为Na2FeO4,按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲醛(HCHO) |
| B、CO |
| C、氡(Rn) |
| D、NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(A)=0.15 mol?L-1?min-1 |
| B、v(B)=0.015 mol?L-1?s-1 |
| C、v(C)=0.40 mol?L-1?min-1 |
| D、v(D)=0.45 mol?L-1?min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA |
| B、常温下,2.3g Na完全与O2反应失去的电子数为0.1NA |
| C、100mL 18.4mol?L-1的硫酸与足量铜反应,生成二氧化硫的分子数小于0.92 NA |
| D、在密闭容器中加入1.5mol H2和0.5molN2,充分反应后可得到NH3分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸氢钠溶液中加入醋酸:CO32-+2H+=H2O+CO2↑ |
| B、稀硫酸中加入铁粉:2Fe+6H+=2Fe3++3H2↑ |
| C、碳酸钙中加入盐酸:CO32-+2H+=H2O+CO2↑ |
| D、氢氧化钠溶液中加入硫酸:H++OH-=H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 某兴趣小组同学进行乙醛的银镜反应实验的操作步骤如下:
某兴趣小组同学进行乙醛的银镜反应实验的操作步骤如下:| 实验变量 实验序号 | 银氨溶液的量/mL | 乙醛的量/滴 | 温度/℃ | 反应混合液的pH | 出现银镜的时间/min |
| 1 | 1 | 3 | 65 | 11 | 5 |
| 2 | 1 | 3 | 45 | 11 | 6.5 |
| 3 | 1 | 5 | 65 | 11 | 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com