
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ||||
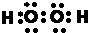 ,故答案为:
,故答案为: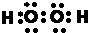 ;
;
| ||
| ||


科目:高中化学 来源: 题型:
| A、澄清石灰水,浓H2SO4 |
| B、酸性KMnO4溶液,浓H2SO4 |
| C、Br2水,浓H2SO4 |
| D、浓H2SO4,酸性KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、发生化学反应时失去电子越多的金属原子,还原能力越强 |
| B、金属阳离子被还原后,不一定得到该元素的单质 |
| C、核外电子总数相同的粒子,一定是同种元素的原子 |
| D、只能与酸反应的氧化物,一定是碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| x值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |


查看答案和解析>>
科目:高中化学 来源: 题型:
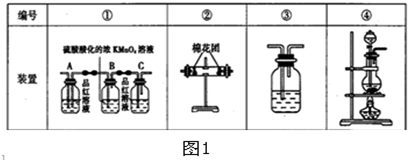
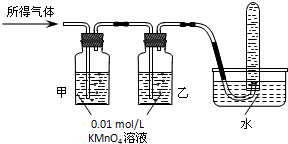
| 实验操作 | 预期现象 | 结论 | |
| 验证猜想Ⅰ | 含有Fe2+和Fe3+ | ||
| 验证猜想Ⅱ | 将所得气体通入如图2所示装置 | 含有两种气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com