
| A. | s能级 | B. | p能级 | C. | d能级 | D. | f能级 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | +92.3 kJ•mol-1 | B. | -92.3 kJ•mol-1 | C. | -184.6 kJ•mol-1 | D. | +184.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 .有关柠檬烯的分析正确的是( )
.有关柠檬烯的分析正确的是( )| A. | 它的一氯代物有6种 | |
| B. | 它和丁基苯( )互为同分异构体 )互为同分异构体 | |
| C. | 一定条件下,它分别可以发生加成、取代、氧化反应 | |
| D. | 它的分子中所有的碳原子一定在同一个平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤⑥ | B. | ①③⑤ | C. | ②④⑥ | D. | 以上全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
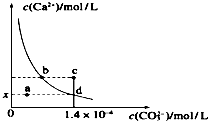 室温时,CaCO3在水中的沉淀溶解平衡曲线如图所示.已知CaCO3的溶度积(室温)为2.8×10-9,下列说法中不正确的是( )
室温时,CaCO3在水中的沉淀溶解平衡曲线如图所示.已知CaCO3的溶度积(室温)为2.8×10-9,下列说法中不正确的是( )| A. | x的数值为2×10-5 | B. | c点时有CaCO3生成 | ||
| C. | 加入蒸馏水可使溶液由d点变成a点 | D. | b点与d点对应的溶度积相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com