
【题目】在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是
A. 氯水使有色布条褪色,说明氯水中含有![]()
B. 向氯水中加入![]() 溶液产生白色沉淀,说明氯水中含有
溶液产生白色沉淀,说明氯水中含有![]()
C. 向氯水中加入![]() 粉末,有气泡产生,说明氯水中含有
粉末,有气泡产生,说明氯水中含有![]()
D. 向氢氧化钠溶液中滴加氯水,溶液黄绿色消失,说明氯水中含有![]()
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】碱性锌锰电池的工作原理:Zn+2MnO2+2H2O![]() 2MnO(OH)+Zn(OH)2,其中的电解质溶液是KOH溶液。某课题组用废旧铁壳无汞碱性锌锰电池为原料,制备一种新型材料——MnxZn(1x)Fe2O4,其工艺流程如图所示:
2MnO(OH)+Zn(OH)2,其中的电解质溶液是KOH溶液。某课题组用废旧铁壳无汞碱性锌锰电池为原料,制备一种新型材料——MnxZn(1x)Fe2O4,其工艺流程如图所示:

(1)已知MnxZn(1x)Fe2O4中锰元素的化合价与实验室用二氧化锰制取氯气时还原产物中的锰相同,则铁元素的化合价为___________。
(2)“溶渣”工序中稀硫酸与铁反应生成的硫酸亚铁可将+3价锰的化合物全部还原成Mn2+,写出该反应的离子方程式:_________________________________。
(3)“调铁”工序的目的是调整滤液中铁离子的总浓度,使其中金属元素的物质的量之比与产品的化学式MnxZn(1x)Fe2O4相符合。
①写出“调铁”工序中发生反应的离子方程式:______________________、_______。
②若测得滤液的成分为c(Mn2+)+c(Zn2+)=a mol·L1,c(Fe2+)+c(Fe3+)=b mol·L1,滤液体积为1 m3,“调铁”工序中,需加入的铁粉质量为___________kg(忽略溶液体积变化,用含a、b的代数式表示)。
(4)在“氧化”工序中,加入双氧水的目的是把 Fe 2+ 氧化为 Fe 3+;生产过程中发现实际消耗双氧水的量大于理论值,其可能原因除温度外,主要是______________________。
(5)用氨水“调pH”后,经“结晶”、“过滤”可得到产品和滤液C,从滤液C中还可分离出一种氮肥,该氮肥的溶液中离子浓度由大到小的排序为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过海水晾晒可得粗盐,粗盐中除含有NaCl外,还含有![]() 以及泥沙等杂质。制备精盐的各步操作流程如下:
以及泥沙等杂质。制备精盐的各步操作流程如下:

(1)在第⑦步蒸发过程中要用玻璃棒搅拌,目的是__________。
(2)第②、④步操作的目的分别是除去粗盐中的![]() 和
和![]() ,需要加入的试剂依次是________(填化学式)。
,需要加入的试剂依次是________(填化学式)。
(3)第⑥步操作中发生反应的化学方程式为________。
(4)在第③步操作中,选择的除杂试剂不能是KOH溶液,理由是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。

请回答下列问题:
(1)步骤I中,粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,粗盐精制过程中要使用Na2CO3溶液,请写出加入Na2CO3溶液后相关化学反应的离子方程式:_________________________。
(2)海水提溴,制得1molBr2至少需要消耗_________molCl2。步骤Ⅲ若用Na2SO3水溶液吸收Br2,有关反应的离子方程式为_________。
(3)用四氯化碳可以将生成的溴提取出来,利用了溴的________性质,为了除去产物中残留的少量Cl2,可向其中加入_________溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
A.标准状况下,11.2L H2O含有的分子数为0.5NA
B.46g NO2和N2O4的混合物含有的原子数为3NA
C.20g NaOH固体溶于1L 水可制得0.5mol/L的NaOH溶液
D.同温同压下,体积相同的氢气和氩气所含的原子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学购买了一瓶“84消毒液”,包装说明如下,下列分析不正确的是( )

A.“84消毒液”保存时不能敞口放置,需要密封保存
B.该“84消毒液”中NaClO的物质的量浓度约为4mol·L-1
C.取100mL该“84消毒液”稀释100倍后用以消毒,稀释后的溶液中c(Na+)约为0.04mol·L-1
D.欲用NaClO固体配制含25% NaClO的消毒液480mL,需要称量的NaClO固体质量为142.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示不同化学元素所组成的化合物,以下说法错误的是

A.若①为某种大分子的组成单位,则①最可能是氨基酸
B.若②是“生命的燃料”,则②可能是葡萄糖
C.若③为能携带遗传信息的大分子物质,则③一定是DNA
D.若④为参与动物血液中脂质运输的物质,则④可能为胆固醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:p[c(HX)/c(X-)]=-lg[c(HX)/c(X-)]。室温下,向0. 10 mol/LHX溶液中滴加0.10 mol/L NaOH溶液,溶液pH随p[c(HX)/c(X-)]变化关系如图。下列说法不正确的是
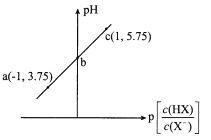
A. 溶液中水的电离程度:a<b<cB. 图中b点坐标为(0,4.75)
C. c点溶液中:c(Na+) =l0c(HX)D. 室温下HX的电离常数为10-4. 75
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr![]() C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
A. 加入NaOH,可增大乙醇的物质的量
B. 增大HBr浓度,有利于生成C2H5Br
C. 若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D. 若起始温度提高至60℃,可缩短反应达到平衡的时间
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com