
| 温度/℃ | 400 | 427 | 700 | 800 |
| 平衡常数 | 9.94 | 9 | b | 0.64 |
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3[m] |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |

分析 (1)由表可知,温度越高,平衡常数越小,反应进行程度越小,平衡向逆反应移动,升高温度平衡向吸热方向移动;
(2)根据v=$\frac{△c}{△t}$计算反应速率;
(3)起始时水的物质的量为5Xmol,CO的物质的量为 5(1-X)mol,利用三段式法求出平衡时各组分的物质的量,代入800℃平衡常数,据此解答;
(4)根据浓度、压强、温度对平衡移动的影响分析.
(5)到达平衡时转化率最大,令平衡时CO的浓度变化量为cmol/L,根据三段式法用c表示出平衡时各组分个浓度,再利用平衡常数列方程,求出c,再利用转化率定义计算;
(6)反应是放热反应,升高温度平衡逆向进行,逆反应速率大于正反应速率,最后达到新的平衡,据此画出图象曲线;
解答 解:(1)由表可知,温度越高,平衡常数越小,反应进行程度越小,平衡向逆反应移动,升高温度平衡向吸热方向移动,故正反应为放热反应,故答案为:放热;
(2)v(CO)=$\frac{0.2mol/L-0.08mol/L}{4min}$=0.03mol/(L•min),故答案为:0.03mol/(L•min);
(3)因800℃时反应平衡常数为1.起始时水的物质的量为5Xmol,CO的物质的量为 5(1-X)mol,则
CO(g)+H2O(g)?H2(g)+CO2(g),
起始:5(1-X) 5X 0 0
转化:5(1-X)Y 5(1-X)Y 5(1-X)Y 5(1-X)Y
平衡:5(1-X)(1-Y) 5(X-Y+XY) 5(1-X)Y 5(1-X)Y
所以平衡常数k=$\frac{c({H}_{2})c(C{O}_{2})}{c(CO)c({H}_{2}O)}$=$\frac{5(1-x)y×(1-x)y}{5(1-x)(1-y)×5(x-y+xy)}$=1,解得Y=X,故答案为:Y=X;
(4)①在高于850℃时发生反应,化学反应速率加快,一定在4min前达到化学平衡.另外从表中可看出反应在3min和4min时的各物质浓度相同,故3min-4min之间反应应处于平衡状态;
故答案为:平衡,反应在3min和4min时的各物质浓度相同;
②表中5min-6min之间CO浓度减少,H2O浓度增大,CO2浓度增大,只有增加水蒸气,使化学平衡向正反应方向移动,故选A,故答案为:A;
(5)设CO的浓度变化量为c,则
CO(g)+H2O(g)?H2(g)+CO2(g),
起始:0.02 0.020 0 0
转化:c c c c
平衡:0.02-c 0.02-c c c
代入500℃时反应平衡常数有k=$\frac{c({H}_{2})c(C{O}_{2})}{c(CO)c({H}_{2}O)}$=$\frac{{c}^{2}}{(0.02-c)^{2}}$=9,解得c=0.015,
CO的最大所以转化率为$\frac{0.015}{0.2}$×100%=75%,故答案为:75%;
(6)反应是放热反应,升高温度平衡逆向进行,逆反应速率大于正反应速率,最后达到新的平衡,据 此画出图象曲线为: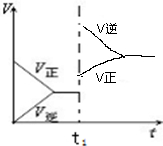 ,
,
故答案为: ;
;
点评 本题主要考查反应速率的计算、平衡移动的影响因素、平衡常数的计算,难度较大,要注意平衡常数只受温度的影响.


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ①②⑤⑥ | C. | ②③④ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
. .
. ,
, 、
、 .(写两种即可)
.(写两种即可)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  盐桥中的K+移向ZnSO4溶液 | |
| B. | 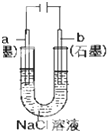 工作一段时间后,a极附近溶液的C(OH-)增大 | |
| C. | 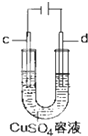 工作时,c极为发生氧化反应 | |
| D. |  电子由Zn流向Fe,装置中有Fe2+生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molS(s ) 和1molO2(g)反应生成1molSO2(g)时放出297.23kJ的热量 | |
| B. | S(g)+O2(g)=SO2(g)放出的热量大于297.23 kJ•mol-1 | |
| C. | S(g)+O2(g)=SO2(g)放出的热量小于297.23 kJ•mol-1 | |
| D. | 形成1 mol SO2的化学键所释放的总能量大于断裂1 mol S(s)和1 mol O2的化学键所吸收的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 在容积恒定的密闭容器中进行反应 2NO+O2=2NO2 该反应的反应速率随时间变化的关系如图所示.若t2、t4时刻只改变一个条件,下列说法正确的是( )
在容积恒定的密闭容器中进行反应 2NO+O2=2NO2 该反应的反应速率随时间变化的关系如图所示.若t2、t4时刻只改变一个条件,下列说法正确的是( )| A. | 在t5时,容器NO2的体积分数是整个过程中的最大值 | |
| B. | 在t2时,采取的措施可以是增大压强 | |
| C. | 在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态 | |
| D. | 在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④③②① | B. | ④①②③ | C. | ①③②④ | D. | ③①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | Fe(OH)2 |
| pH | 3.2 | 6.7 | 8.0 | 9.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com