
下列实验现象与对应结论均正确的是
选项 | 操作 | 现象 | 结论 |
A | 将浓硫酸滴到胆矾晶体上 | 晶体逐渐变成白色 | 该过程发生物理变化 |
B | 将过量过氧化钠固体投入紫色石蕊试液中 | 溶液变成蓝色 | 过氧化钠与水反应生成氢氧化钠,溶液呈碱性 |
C | 向硝酸亚铁溶液中滴入稀硫酸 | 无明显现象 | 硝酸亚铁与硫酸不反应 |
D | 将滴有酚酞的氨水加热 | 红色逐渐变浅 | 一水合氨受热分解,导致溶液碱性减弱 |
 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源:2015-2016学年浙江省温州十校联合体高一上学期期中测试化学试卷(解析版) 题型:选择题
关于萃取的理解,下列说法正确的是
A.可以用四氯化碳把溴水中的溴萃取出来,静置分层后,上层呈橙红色
B.可以用酒精萃取碘水中的碘
C.可以用水做萃取剂把碘从四氯化碳溶液中分离出来
D.萃取之后一般通过分液的方法将互不相溶的液体分离
查看答案和解析>>
科目:高中化学 来源:2016届江西省南昌市高三上学期第三次考试化学试卷(解析版) 题型:选择题
下图是氯气的制备以及氯、溴、碘的非金属性比较实验,充分反应一段时间后,打开装置D的活塞,将装置D中少量溶液加入装置E中,振荡,观察实验现象,下列说法正确的是
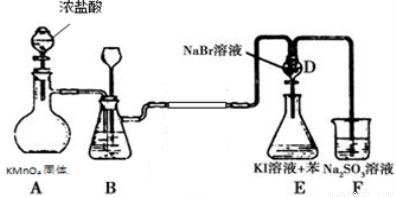
A.F2不能与NaCl溶液反应置换出氯气
B.装置B中可盛放水吸收氯气中的HCl气体
C.装置E下层呈现紫红色
D.装置E中有机试剂层呈现紫红色,能说明非金属性Br>I
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江哈尔滨师大附中高三上学期期中考试化学试卷(解析版) 题型:选择题
向100mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2 mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如右图所示。下列判断正确的是
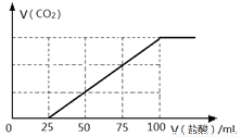
A.原NaOH溶液的浓度为0.1 mol/L
B.通入CO2的体积为448 mL
C.所得溶液的溶质成分的物质的量之比为n(NaOH):n(Na2CO3) = 1: 3
D.所得溶液的溶质成分的物质的量之比为n(NaHCO3):n(Na2CO3) = 2: 1
查看答案和解析>>
科目:高中化学 来源:2016届河南省高三上学期第八次大考化学试卷(解析版) 题型:选择题
在某2L恒容密闭容器中充入2 mol X(g)和1 mol Y(g)发生反应:2X(g)+Y(g) 3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是
3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是

A.M点时,Y的转化率最大
B.升高温度,平衡常数减小
C.平衡后充入Z达到新平衡时Z的体积分数增大
D.W,M两点Y的正反应速率相等
查看答案和解析>>
科目:高中化学 来源:2016届广西柳州铁路第一中学高三上学期10月月考理化学试卷(解析版) 题型:选择题
常温下,下列各组微粒在指定溶液中一定能大量共存的是( )
A.0.1 mol/L AgNO3溶液:H+、K+、SO42﹣、I﹣
B.加入苯酚显紫色的溶液:K+、NH4+、Cl﹣、I﹣
C.甲基橙呈红色的溶液中:MnO4﹣、Al3+、C2H5OH、SO42﹣
D. =0.1mol/L的溶液:K+、Na+、SiO32﹣、NO3﹣
=0.1mol/L的溶液:K+、Na+、SiO32﹣、NO3﹣
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林实验中学高二上学期期中考试化学试卷(解析版) 题型:选择题
室温下,下列溶液中的微粒浓度关系正确的是( )
A.新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-)
B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
C.Na2CO3溶液:c(Na+)+c(H+)=2c(CO32-)+c(OH-)
D.0.2 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合:2c(Na+)= c(CH3COO-)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源:2016届陕西西安第一中学高三上学期期中考试化学试卷(解析版) 题型:选择题
图表归纳是学习化学的一种常用方法,某同学如下归纳的下表与上图中对应正确的是
选项 | X | Y | Z |
|
A | 胶体 | 混合物 | 淀粉溶液 | |
B | 化合物 | 酸性氧化物 | 一氧化氮 | |
C | 气态氢化物 | 化合物 | 液溴 | |
D | 强电解质 | 强酸 | 硫酸 |
查看答案和解析>>
科目:高中化学 来源:2016届贵州省遵义市高三上学期第一次联考化学试卷(解析版) 题型:实验题
某学习小组进行了如下课外活动,邀请你参与:
(1)研究水溶液中复分解型离子反应的发生条件,设计如下方案:
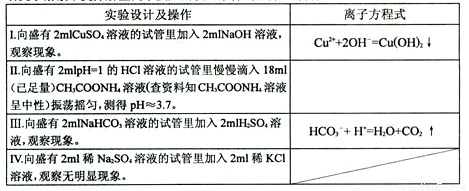
①写出II实验中发生反应的离子方式: 。
②根据实验发现只要有 等物质生成,水溶液中复分解型离子反应就可以发生。
③经过小组同学积极思考、讨论交流发现在生成三类物质后,导致一个共同的结果,于是得出结论:溶液中复分解型的离子反应总是向着某些____ 的方向进行(与溶液混合的瞬间相比)。
④小组同学进一步深入思考,发现上述问题其实质是化学反应进行的方向问题。请你结合化学反应原理的相关知识对③中的结论作出合理解释: 。
(2)如何研究H2SO4、KC1、NaHSO4、NaNO3、Na2CO3、NH4C1、NaOH的性质?设计方案为:将它们按照酸、碱、盐分类,然后分别溶于水得到溶液,进行实验。具体如下:
①根据方案进行分类时,经实验测得KC1、NaNO,溶液的pH=7;H2SO4、NaHSO4、NH4Cl溶液的pH<7; Na2CO3、NaOH溶液的pH>7。由此有的同学按分类法思想把H2SO4、NaHSO4、NH4Cl都划分为酸类,请你运用中学化学相关理论判断这样划分是否合理?并简要说明理由。____ 、____ 。
②向NaHSO4、NaNO3的混合溶液中,滴加Na2S溶液产生黄色沉淀和无色气体,写出反应的离子方程式:___ _。反应中若生成标准状况下的无色气体1.12L,则被氧化的物质为 mol,转移电子的物质的量为 mol。
③某同学在用H2SO4鉴别NaNO3、Na2CO3、NaOH溶液时,Na2CO3很容易鉴别,但鉴别NaNO3和NaOH时却陷入了困境。限用上述另外六种物质,请你设计一个现象明显的实验方案帮忙解决这一难题:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com