
相同温度下,根据三种酸的电离常数,下列判断正确的是( )
| 酸 | HX | HY | HZ |
| 电离常数K | 9×10-7 | 9×10-6 | 10-2 |
A.三种酸的强弱关系:HX>HY>HZ
B.反应HZ+Y-====HY+Z-能够发生
C.相同温度下,0.1 mol·L-1的NaX、NaY、NaZ溶液,NaZ溶液pH最大
D.相同温度下,1 mol·L-1HX溶液的电离常数大于0.1 mol·L-1HX
科目:高中化学 来源: 题型:
下列解释事实的化学方程式或离子方程式正确的是
A.以MnO2为原料制得的MnCl2溶液中常含有Cu2+等金属离子,通常添加难溶电解质MnS使这些离子形成硫化物沉淀而除去:Cu2+ + S2-=CuS↓
B.盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2 + 2OH- = SiO32- + H2O
C.金属钠在空气中放置表面会很快失去金属光泽:2Na + O2 = Na2O2
D.向硫酸亚铁铵[(NH4)2Fe(SO4) 2·6H2O]的稀溶液中加入足量Ba(OH)2稀溶液:NH4+ + Fe2+ + SO42-+ Ba2+ +3OH- = BaSO4↓+ Fe(OH)2↓+ NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
利用化学的知识,可解释生活中的现象。
(1)用活性炭可以除去冰箱中的异味,因为活性炭具有 性。
(2)氧化钙可作干燥剂,因为 ________。(用化学方程式回答)
(3)使用铁锅炒菜时,适当添加一些醋,有利于生成人体易吸收的亚铁离子,可有效防治的疾病是__________。
(4)用小苏打治疗胃酸过多,其反应化学方程式是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用0.01 mol·L-1NaOH溶液完全中和pH=3的下列溶液各
100 mL需NaOH溶液体积最大的是( )
A.盐酸 B.硫酸 C.高氯酸 D.醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平 衡常数 | Ka= 1.8×10-5 | Ka1= 4.3×10-7 | Ka2= 5.6×10-11 | Ka= 3.0×10-8 |
回答下列问题:
(1)物质的量浓度均为0.1 mol·L-1的四种溶液:
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
pH由小到大的排列顺序是 (用编号填写)。
(2)常温下,0.1 mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是 。
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)·c(OH-) D.c(OH-)/c(H+)
E.c(H+)·c(CH3COO-)/c(CH3COOH)
(3)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数 (填“大于”“小于”或“等于”)CH3COOH的电离平衡常数,理由是 。
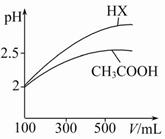
查看答案和解析>>
科目:高中化学 来源: 题型:
在基态钾原子中,关于核外电子能量的叙述错误的是( )
A.最易失去的电子能量最高
B.2p能级上6个电子能量完全相同
C.p能级上电子能量一定高于s能级上电子能量
D.在离核最近区域内运动的电子能量最低
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应N2O4(g) 2NO2(g)在温度一定时,平衡体系中NO2的体积分数φ(NO2)随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点),下列说法正确的是( )
2NO2(g)在温度一定时,平衡体系中NO2的体积分数φ(NO2)随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点),下列说法正确的是( )
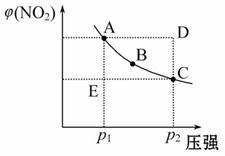
A.A、C两点的正反应速率的关系为A>C
B.A、B、C、D、E各状态中,v(正)<v(逆)的是状态E
C.维持p1不变,E→A所需的时间为x;维持p2不变,D→C所需时间为y,则x<y
D.使E状态从水平方向到达C状态,从理论上来讲,可选用的条件是从p1突然加压至p2
查看答案和解析>>
科目:高中化学 来源: 题型:
等离子体的用途十分广泛,运用等离子体束切割金属或者进行外科手术,利用了等离子体的特点是( )
A.微粒带有电荷 B.高能量
C.基本构成微粒多样化 D.准电中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com