
科目:高中化学 来源:知识精讲与能力训练 高三化学 题型:013
已知有如下三个反应:①N2+O2![]() 2NO.②2NO+O2
2NO.②2NO+O2![]() 2NO2,③4NH3+6NO
2NO2,③4NH3+6NO![]() 5N2+6H2O,由此可以判断,在通常情况下,N2、NO、NH3的还原性强弱顺序是
5N2+6H2O,由此可以判断,在通常情况下,N2、NO、NH3的还原性强弱顺序是
[ ]
查看答案和解析>>
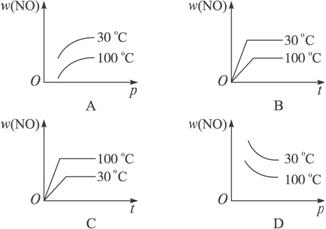
科目:高中化学 来源:江苏省苏州中学2006-2007学年度高三化学初考试卷 题型:038
| |||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
A.此过程中,NO2是催化剂 B.在此过程中,NO是中间产物
C.此过程的总方程式为2O3![]() 3O2 D.光化学烟雾能引起人的外呼吸功能严重障碍
3O2 D.光化学烟雾能引起人的外呼吸功能严重障碍
查看答案和解析>>
科目:高中化学 来源:期末题 题型:填空题
 2NO写出该反应的平衡常数表达式:_________
2NO写出该反应的平衡常数表达式:_________ 2NH3和②N2+O2
2NH3和②N2+O2  2NO的平衡常数(K)与温度的关系。根据图中的数据分析,下列说法正确的是( )。
2NO的平衡常数(K)与温度的关系。根据图中的数据分析,下列说法正确的是( )。 
查看答案和解析>>
科目:高中化学 来源: 题型:
A.分解反应 B.置换反应 C.化合反应 D.复分解反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com