
在一定条件下,将A2和B2气体通入1 L密闭容器中,反应按下式进行:mA2+nB22C,2 s内反应速率如下:v(A2)=0.5 mol·L-1·s-1,v(B2)=1.5 mol·L-1·s-1,v(C)=1 mol·L-1·s-1,则m和n的值分别为( )
A.2、3 B.3、2
C.3、1 D.1、3
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
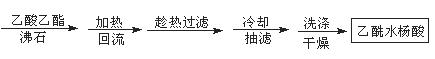
阿司匹林(乙酰水杨酸)已应用百年,成为医药史上三大经典药物之一,至今它仍是世界上应用最广泛的解热、镇痛和抗炎药,也是作为比较和评价其他药物的标准制剂。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成该物质,设计的合成路线为:
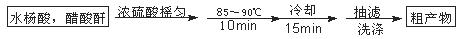
一、制备
二、提纯
方案1

方案2
主要试剂和产品的物理常数
| 名 称 | 相对分子质量 | 熔点或沸点(0C) | 水 | 醇 | 醚 |
| 水杨酸 | 138 | 158(熔点) | 微溶 | 易溶 | 易溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 反应 | 可溶 | 易溶 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 | 可溶 | 微溶 |
请根据以上信息回答下列问题:
 (1)①合成阿斯匹林时,还会生成一些副产品,其中有一种是高分子,为了分离此物质,方案1中加入A物质为 溶液。
(1)①合成阿斯匹林时,还会生成一些副产品,其中有一种是高分子,为了分离此物质,方案1中加入A物质为 溶液。
②本方案抽滤 后进行洗涤,其具体操作是 。
后进行洗涤,其具体操作是 。
(2)方案2为改进的提纯方法,称为重结晶提纯法。
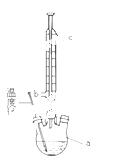
①步骤2回流的装置如图所示,写出仪器a的名称 ,使用温度计的目的是 ,冷凝水的流向为 。
②方案2所得产品的有机杂质要比方案1少的原因是 。
(3)该学习小组在实验中原料用量:2.0g水杨酸、5.0ml醋酸酐(ρ=1.08g·cm-3),最终称量产品m=2.2g ,则乙酰水杨酸的产率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D都是含碳、氢、氧的单官能团化合物,A水解得B和C,B氧化可以得到C或D,D氧化也得到C。若M(X)表示X的摩尔质量,则下式中正确的是( )
A.M(A)=M(B)+M(C)
B.2M(D)=M(B)+M(C)
C.M(B)<M(D)<M(C)
D.M(D)<M(B)<M(C)
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.100 mL 0.1 mol/L K2SO4溶液中,含有氧原子数为0.04 NA
B.100 g 17%的氨水中,含有氨分子数为NA
C.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA
D.25 ℃时,1.0 L pH=13的Ba(OH)2溶液中,含有的OH-数目为0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
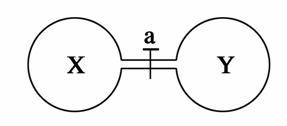
常温常压下,两个容积相同的烧瓶中分别盛满X和Y两种气体,打开开关a,使两烧瓶内的气体相通,最后容器内的压强由大到小的顺序排列正确的是( )
| 编号 | ① | ② | ③ | ④ |
| 气体X | HI | NH3 | H2 | NO |
| 气体Y | Cl2 | HCl | Cl2 | O2 |
A.②>③>①>④ B.③>①=④>②
C.③>①>④>② D.④>①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
运用相关化学知识进行判断,下列结论错误的是( )
A.某吸热反应能自发进行,因此该反应是熵增反应
B.NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中
C.可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底
D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
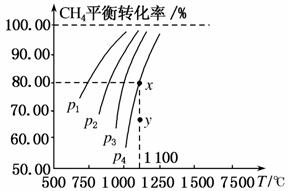
在一恒容的密闭容器中充入0.1 mol/L CO2、0.1 mol/L CH4,在一定条件下发生反应:CH4(g)+CO2(g)2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是( )
A.上述反应的ΔH<0
B.压强:p4>p3>p2>p1
C.1 100 ℃时该反应平衡常数为1.64
D.压强为p4时,在y点:v正>v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25 ℃)。
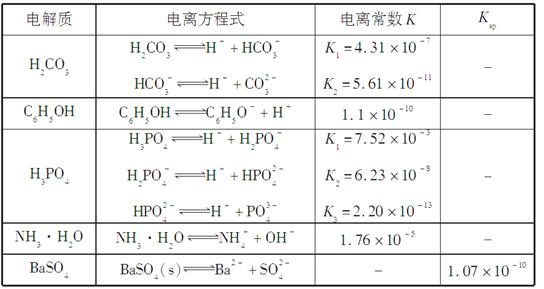
回答下列问题:
(1)写出C6H5OH与Na3PO4反应的离子方程式______________。
(2)25 ℃时,向10 mL 0.01 mol·L-1 C6H5OH溶液中滴加V mL 0.01 mol·L-1氨水,混合溶液中粒子浓度关系正确的是________(填选项字母)。
a.若混合液pH>7,则V≥10
b.V=5时,2c(NH3·H2O)+2c(NH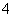 )=c(C6H5O-)+c(C6H5OH)
)=c(C6H5O-)+c(C6H5OH)
c.V=10时,混合液中水的电离程度小于0.01 mol·L-1 C6H5OH溶液中水的电离程度
d.若混合液pH<7,则c(NH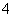 )>c(C6H5O-)>c(H+)>c(OH-)
)>c(C6H5O-)>c(H+)>c(OH-)
(3)水解反应的化学平衡常数称为水解常数(用Kh表示),类比化学平衡常数的定义。25℃时,Na2CO3第一步水解反应的水解常数Kh=________
mol·L-1。
(4)如图所示,有T1、T2不同温度下两条BaSO4在水中的沉淀溶解平衡曲线(已知BaSO4的Ksp随温度升高而增大)。
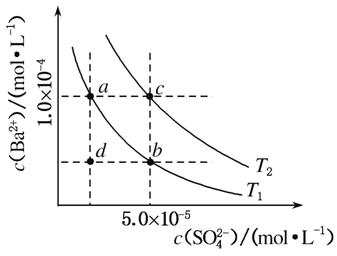
①T2________25 ℃(填“>”“<”或“=”)。
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是________(填选项字母)。
a.加入Na2SO4不能使溶液由a点变为b点
b.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
c.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
d.升温可使溶液由b点变为d点
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大,原因是增加了反应物分子中活化分子的百分数
D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com