
分析 (1)根据混合气体与氢气的相对密度可以计算出混合气体的平均分子质量:11.2×2=22.4,结合烯烃的最小相对分子质量判断一定存在甲烷;根据n=$\frac{m}{M}$计算出混合气体的物质的量,溴水增重的质量为烯烃的质量,从而得出甲烷的质量,根据n=$\frac{m}{M}$计算出甲烷的物质的量,再计算出烯烃的物质的量,列式计算出该烯烃的分子式,只写出其结构简式即可;
(2)根据(1)的计算结果及同分异构体、同系物的概念进行判断;
(3)烯烃分子中含有碳碳双键,与溴单质发生加成反应,据此写出反应的化学方程式.
解答 解:(1)混合气体密度为同状况下H2密度的11.2倍,则平均相对分子质量为11.2×2=22.4,烯烃中最简单为乙烯,其相对分子质量为28,大于22.4,故一定含有甲烷,则A的结构简式为:CH4,
混合气体总物质的量为:$\frac{9g}{22.4g/mol}$=$\frac{9}{22.4}$mol,将混合气体通过足量的溴水,溴水增重4.2g为烯烃的质量,甲烷的质量=9g-4.2g=4.8g,甲烷的物质的量=$\frac{4.8g}{16g/mol}$=0.3mol,烯烃的物质的量=$\frac{9}{22.4}$mol-0.3mol,设烯烃组成通式CnH2n,故14n g/mol×($\frac{9}{22.4}$mol-0.3mol)=4.2 g,解得:n≈3,故烯烃的分子式为C3H6,为丙烯,其结构简式为:CH2=CHCH3,
故答案为:CH4;CH2=CHCH3;
(2)B为丙烯,丙烯和丁烯都是单烯烃,二者互为同系物,
故答案为:同系物;
(3)丙烯与溴水发生加成反应生成1,2-二溴丙烷,反应的方程式为:CH2=CH-CH3+Br2→CH3CHBrCH2Br,
故答案为:CH2=CH-CH3+Br2→CH3CHBrCH2Br.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,注意掌握常见有机物结构与性质,根据混合气体与氢气的相对密度判断其平均分子质量及烷烃的名称为解答关键,试题侧重考查学生的分析、理解能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
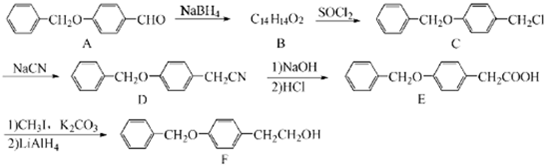
 ;由C→D的反应类型是:取代反应.
;由C→D的反应类型是:取代反应. .
. 为原料制备化合物X(结构简式见图)的合成路线流程图(无机试剂可任选).合成路线流程图示例如图:CH3CHO$→_{催化剂△}^{O_{2}}$CH3COOH$→_{浓硫酸△}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.
为原料制备化合物X(结构简式见图)的合成路线流程图(无机试剂可任选).合成路线流程图示例如图:CH3CHO$→_{催化剂△}^{O_{2}}$CH3COOH$→_{浓硫酸△}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
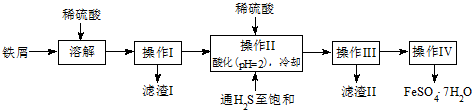
| 饱和H2S溶液 | SnS沉淀完全 | FeS开始沉淀 | FeS沉淀完全 | |
| pH值 | 3.9 | 1.6 | 3.0 | 5.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在涂料中尽量用液态有机物代替水作溶剂,以减少环境污染 | |
| B. | 向煤中加入适量石灰石,在煤燃烧时SO2最终生成CaSO4,可减少对大气的污染 | |
| C. | “海水淡化”可以解决“淡水供应危机”,加入明矾可以使海水淡化 | |
| D. | 食物溶于水后的溶液 pH<7,则该食物为成酸性食物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| B. | 0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(H+)+c(Cl-)>c(NH4+)+c(OH-) | |
| D. | 0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸、硫酸镁、碳酸钠、氢氧化钠 | B. | 硝酸钾、碳酸钠、氯化钙、氯化钡 | ||
| C. | 盐酸、硫酸钠、偏铝酸钠、氢氧化钾 | D. | 硫酸、硫酸铝、氯化钠、氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:S2->Na+>O2->H+ | B. | 与水反应的剧烈程度:K>Na>Mg>Ca | ||
| C. | 熔点:CO2>SiO2>Na2O>SO3 | D. | 还原性:PH3>H2S>HCl>HF |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
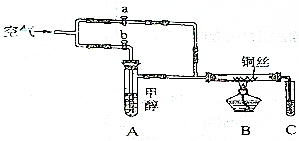 如图所示装置,通入空气,开启a、b两个活塞,灼热铜丝,下列有关分析正确的是( )
如图所示装置,通入空气,开启a、b两个活塞,灼热铜丝,下列有关分析正确的是( )| A. | 灼热铜丝发生的现象变化为紫红色和黑色交替出现,甲醇发生还原反应 | |
| B. | C中有机产物易溶于水,与水分子间只形成1种氢键 | |
| C. | 检验C中产物的试剂可用1mol•L-1的CuSO4溶液2mL和0.4mol•L-1的NaOH | |
| D. | 可用酸性高锰酸钾溶液检验产物生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
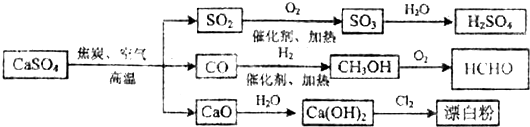
| A. | 除去与水反应外,图示中其它的转化反应均为氧化还原反应 | |
| B. | CO、SO2、SO3 均是酸性氧化物 | |
| C. | 工业上利用Cl2和澄清石灰水反应来制取漂白粉 | |
| D. | 用CO合成CH3OH 进而合成HCHO的两步反应,原子利用率均为100% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com