
| A. | 1×1010cm | B. | 1×10-8m | C. | 1×10-10cm | D. | 1×10-10m |
科目:高中化学 来源: 题型:选择题
| A. | 1.00mol NaCl中含有6.02×1023个NaCl分子 | |
| B. | 欲配制1.00 L 1.00mol•L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中 | |
| C. | 1.00mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023 | |
| D. | 电解58.5g 熔融的NaCl,能产生22.4 L氯气(标准状况)、23.0g金属钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠常温下与氧气反应生成Na2O,升高温度生成 Na2O的速率加快 | |
| B. | 常温下,铜与稀硝酸反应生成NO,增大硝酸的浓度,生成NO的速率加快 | |
| C. | 锌与稀硫酸制备氢气,加入少量的硫酸铜溶液,生成H2的速率加快 | |
| D. | 对密闭容器中发生的反应2NO2?2NO+O2 缩小体积,增大压强,V(正)减小,V(逆)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+、K+、CO32-、Cl- | B. | Ba2+、Na+、SO42-、NO3- | ||
| C. | Ca2+、Na+、NO3-、Cl- | D. | H+、Na+、OH-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,5.6L O2作氧化剂时转移电子数一定为NA | |
| B. | 用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA | |
| C. | 已知3BrF3+5H2O═HBrO3+Br2+9HF+O2↑如果有5molH2O参加氧化还原反应,则由水还原的BrF3分子数目为3NA | |
| D. | 142gNa2SO4和Na2HPO4固体混合物中,阴阳离子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛.某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究.
ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛.某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究.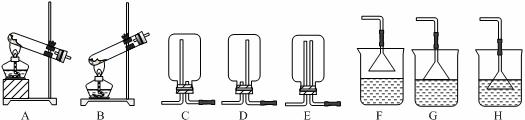
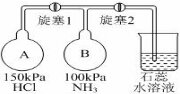
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com