
【题目】海洋约占地球表面积的71%,具有十分巨大的开发潜力,通过海水的综合利用可获得许多物质供人类使用.
(1)Ⅰ、海水中制得的氯化钠除食用外,还用作工业原料,例如通常以NaCI、CO2和NH3为原料制取纯碱,请写出第一步制取NaHCO3的化学方程式: .
(2)Ⅱ、工业上以浓缩海水为原料提取溴的部分流程如图1:
已知:Br2常温下呈液态,易挥发,有毒:2Br2+3CO32﹣=5Br﹣+BrO3﹣+3CO2 .
①通过步骤①氯气氧化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化来重新获得含Br2的溶液,原因是 .
②反应釜2中发生反应的离子方程式为 .
③向蒸馏塔中通入水蒸气加热,控制温度在90℃左右进行蒸馏的原因是 .
(3)Ⅲ、盐卤蒸发冷却后析出卤块的主要成分是MgCI2 , 此外还含有Fe2+、Fe3+、Mn2+等离子.以卤块为原料制得镁的工艺流程如图2(部分操作和条件已略去):
生成氢氧化物沉淀的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH)2 | 9.6 | 11.1 |
①用NaClO氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是 .
②步骤③需在HCl保护气中加热进行,请用化学平衡移动原理解释原因 .
③NaClO还能除去盐卤中的CO(NH2)2 , 生成盐和能参与大气循环的物质,除去0.1molCO(NH2)2时消耗NaCIOg.
【答案】
(1)NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl
(2)富集溴,提高Br2的浓度;5Br﹣+BrO3﹣+6H+=3Br2+3H2O;温度过低难以将Br2蒸发出来,但温度过高又会将大量的水蒸馏出来
(3)ClO﹣+2Fe2++5H2O=2Fe(OH)3+Cl﹣+4H+;Mg2++2H2O ![]() Mg(OH)2+2H+ , 温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl;22.35
Mg(OH)2+2H+ , 温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl;22.35
【解析】解:Ⅰ、以NaCl、NH3、CO2和水等为原料制取NaHCO3的化学方程式为:NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl,所以答案是:NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl;Ⅱ、(1)从①出来的溶液中溴的含量不高,如果直接蒸馏,得到产品成本高,所以经过吹出、吸收、酸化来重新获得含Br2的溶液,其目的为富集溴,提高Br2的浓度,
所以答案是:富集溴,提高Br2的浓度;(2)发生归中反应,离子方程式为:5Br﹣+BrO3﹣+6H+=3Br2+3H2O,所以答案是:5Br﹣+BrO3﹣+6H+=3Br2+3H2O;(3)温度过高水蒸气蒸出,溴中含有水分,温度过低溴不能完全蒸出,产率低,所以控制温度在90℃左右进行蒸馏,所以答案是:温度过低难以将Br2蒸发出来,但温度过高又会将大量的水蒸馏出来;
Ⅲ、盐卤加水溶解,加NaClO将Fe2+氧化成Fe3+ , 然后加入NaOH调节pH为9.8,使Fe2+、Fe3+、Mn2+转化为氢氧化物沉淀,过滤,滤液经过蒸发浓缩、冷却结晶、过滤得到,氯化镁晶体,在HCl气氛中加热得到无水氯化镁,电解熔融的氯化镁得到Mg;(1)加入次氯酸钠会氧化亚铁离子为三价铁,则次氯酸钠与Fe2+、H2O反应生成Fe(OH)3、Cl﹣和H+ , 反应的离子方程式为:ClO﹣+2Fe2++5H2O=2Fe(OH)3+Cl﹣+4H+;
所以答案是:ClO﹣+2Fe2++5H2O=2Fe(OH)3+Cl﹣+4H+;(2)镁离子水解生成氢氧化镁和氢离子,Mg2++2H2OMg(OH)2+2H+ , 水解反应属于吸热反应,加热温度升高,水解程度增大,通入HCl时,增加了溶液中的c(H+),能使水解平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl2;所以答案是:Mg2++2H2OMg(OH)2+2H+ , 温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl2;(3)NaClO还能除去盐卤中的CO(NH2)2 , 生成盐和能参与大气循环的物质,其反应为3NaClO+CO(NH2)2═3NaCl+CO2↑+N2↑+2H2O,由方程式中物质之间的关系可知,0.1mol CO(NH2)2消耗NaClO为0.3mol,则m(NaClO)=nM=0.3mol×74.5g/mol=22.35g,所以答案是:22.35.


科目:高中化学 来源: 题型:
【题目】氨气是一种重要化合物,在工农业生产、生活中有着重要应用。
(1)实验室制备NH3,下列方法中可以选用的是_______________。
A.固态氯化铵与熟石灰混合加热 B.固态氯化铵加热分解
C.碱石灰中滴加浓氨水 D.氯化铵溶液与氢氧化钠溶液共热
(2)“氨的催化氧化”是工业生产硝酸的重要步骤。某化学课外活动小组设计了如下装置模拟该实验过程,并用水吸收所得气体制取硝酸(固定装置略去):

①盛装氨水仪器的名称是________。甲装置不需要加热即能同时产生氨气和氧气,则锥形瓶内固体X的化学式为____________。
②乙装置中药品的名称是_________。写出受热时丙装置发生反应的化学方程式________。
③当戊中观察到______现象,则说明戊中制得硝酸。某同学按上图组装仪器并检验气密性后进行实验,并没有观察到此现象,请分析实验失败的可能原因________,如何改进装置_________。
(3)若将氨气和氯气在集气瓶中混合,会出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一,请写出该反应的化学方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以甲苯为原料可以合成某种食用香料(有机物G)和某种治疗肺结核药物的有效成分(有机物PAS﹣Na)的路线如下: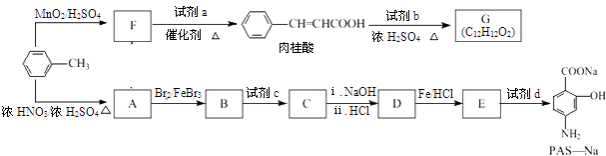
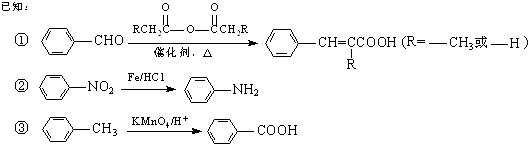
回答下列问题:
(1)由B生成C的反应类型是 .
(2)肉桂酸中含氧官能团的名称是 .
(3)写出由A生成B的化学方程式: .
(4)质谱图显示试剂b的相对分子质量为58,分子中不含甲基,且为链状结构,写出肉桂酸与试剂b生成G的化学方程式: .
(5)当试剂d过量时,可以选用的试剂d是(填字母序号).a.NaOH b.Na2CO3 c.NaHCO3
(6)写出C与NaOH反应的化学方程式: .
(7)在肉桂酸分子中碳碳双键催化加氢后得到化合物X(分子式为C9H10O2),X有多种同分异构体,符合下列条件的有种.a.苯环上有两个取代基; b.能发生银镜反应; c.与Na作用有H2产生.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4mol SO2与2molO2放入4L的密闭容器中,在一定条件下反应达到平衡:2SO2+O22SO3测得平衡时混合物总的物质的量为5mol,求:
(1)平衡时各物质的浓度;
(2)平衡时SO2的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镓(Ga)与铝属于同主族元素,金属镓曾被称为“类铝”,其氧化物和氢氧化物均为两性化合物。工业制备金属镓的流程如下图所示:
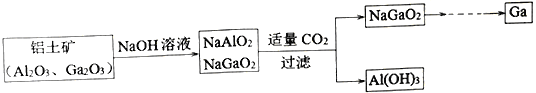
下列判断不合理的是
A. 镓为+3价 B. 碱性:Ga(OH)3>Al(OH)3
C. Ga2O3能与强酸、强碱反应 D. NaGaO2与CO2反应,说明镓的金属性强于铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X,Y,Z三种气体的起始浓度和平衡浓度如表,下列说法错误的是( )
物质 | X | Y | Z |
初始浓度/molL﹣1 | 0.1 | 0.2 | 0 |
平衡浓度/molL﹣1 | 0.05 | 0.05 | 0.1 |
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y2Z,平衡常数为1600
C.其他条件不变时,增大压强可使平衡常数增大
D.改变温度可以改变该反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、F是家庭中常见的有机物,A可以用来除去暖瓶或水壶中的水垢;E是石油化工发展水平的标志,F是一种常见的高分子材料。根据下面转化关系回答下列问题:
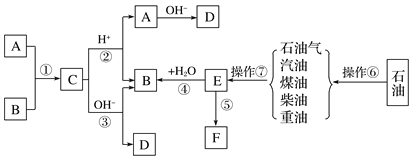
(1)操作⑥、操作⑦的名称分别为________________、________________。
(2)E的结构简式为_________。
(3)B的官能团名称为________,对B的描述正确的是________。
①有毒 ②无色无味 ③密度比水小 ④与酸性高锰酸钾溶液反应使其褪色
⑤在海带提碘实验中作萃取剂从碘水中提取碘单质
⑥在热Cu丝作用下生成相对分子质量比它小2的有机物
A.①③⑤ B.②③④ C.③④⑥ D.④⑤⑥
(4)写出下列反应的化学方程式:
①写出不含18O的A与用18O标记的B在一定条件下发生反应的化学方程式(注明条件和18O的位置):
_______________________________________________________________________,
④E和水反应生成B的方程式(注明条件):
_______________________________________________________________________,
⑤作为家庭中常见的物质,高分子化合物F给我们带来了极大的方便,同时也造成了环境污染,反应⑤的方程式为:___________________________________________________________,
写出有机物B遇到红热的铜丝在空气中反应的化学方程式:
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com