
| A. | 若用标准状况下4.48L CH4还原NO2生成N2和水蒸气,放出的热量为173.4kJ | |
| B. | 由反应①可推知:CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l)△H>-574kJ•mol-1 | |
| C. | 反应①②转移的电子数相同 | |
| D. | 反应②中当4.48L(标准状况)CH4反应完全时转移的电子的物质的量为1.6mol |
分析 A、根据反应①②,利用盖斯定律结合热化学方程式系数的意义来回答;
B、气态水转变为液态水要放热;
C、根据化合价升高数=化合价降低数=转移电子数来回答;
D、根据化合价升高数=化合价降低数=转移电子数来回答.
解答 解:A、由反应①②,利用盖斯定律,反应CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)可以是$\frac{1}{2}$(①+②)得到,所以该反应的△H=-867kJ•mol-1,即4.48L(0.2mol)CH4 还原NO2至N2,放出的热量为173.4kJ,故A正确;
B、因为气态水转变为液态水要放热,所以由反应①可推知:CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l)△H<-574kJ•mol-1,故B错误;
C、反应①②转移的电子数=化合价升高数=化合价降低数=8,转移电子相同,故C正确;
D、反应CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)转移电子数是8mol,4.48L(0.2mol)CH4还原NO2至N2,整个过程中转移的电子总数为1.6mol,故D正确;
故选B.
点评 本题考查学生热化学方程式的含义以及化学方程式电子转移知识,属于综合知识的考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | KClO3是氧化剂 | |
| B. | 被氧化与被还原的氯元素的质量比为5:1 | |
| C. | H2SO4既不是氧化剂又不是还原剂 | |
| D. | 反应中KCl被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量浓硫酸溅在皮肤上,立即用NaOH溶液冲洗 | |
| B. | 酒精洒在桌面上引起失火,可用水浇灭 | |
| C. | 轻度烧伤、烫伤可用冰水或者冷水降温止痛 | |
| D. | 误服可溶性钡盐,可及时服用Na2CO3溶液解毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
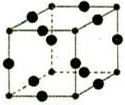 Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用.
Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N×10-2 mol/L | B. | $\frac{N}{1.204×1022}$ mol/L | ||
| C. | $\frac{N}{6.02×1021}$mol/L | D. | $\frac{N}{6.02×1025}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10(b+2a-c) | B. | (2b-c):0.3 | C. | (2b-a+c):0.3 | D. | 10(b-c) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molN2,3molH2 | 2molNH3 | 4molNH3 |
| NH3的浓度(mol•L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | α1 | α2 | α3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com