
对于常温下的0.1 mol·L-1的NH4Cl溶液,请填空:
(1)溶液的pH________7(填“>”、“<”或“=”)。
(2)各类离子,其浓度由大到小的排列顺序是______________。
(3)存在的电荷守恒关系为____________________________。
(4)c(NH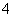 )+c(NH3·H2O)=________(填数字或离子浓度均可)。
)+c(NH3·H2O)=________(填数字或离子浓度均可)。
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是
A.铝粉投入到NaOH溶液中:2Al+2OH-══ 2AlO2-+H2↑
B.铁与盐酸反应: Fe + 2H+ ══ Fe3+ + H2 ↑
C.用小苏打治疗胃酸过多: H+ +HCO3-══ H2O + CO2↑
D.Ba(OH)2与稀H2SO4反应: Ba2++OH-+H++SO42-══ BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
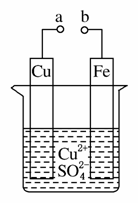
某小组为研究电化学原理,设计如图装置。下列叙述不正确的是( )
A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为Cu2++2e-===Cu
C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D.a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.盐酸中滴加氨水至中性,溶液中溶质为氯化铵
B.稀醋酸加水稀释,醋酸电离程度增大,溶液的pH减小
C.饱和石灰水中加入少量CaO,恢复至室温后溶液的pH不变
D.沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强
查看答案和解析>>
科目:高中化学 来源: 题型:
向体积为Va的0.05 mol·L-1 CH3COOH溶液中加入体积为Vb的0.05 mol·L-1 KOH溶液,下列关系错误的是( )
A.Va>Vb时:c(CH3COOH)+c(CH3COO-)>c(K+)
B. Va=Vb时:c(CH3COOH)+c(H+)=c(OH-)
C. Va<Vb时:c(CH3COO-)>c(K+)>c(OH-)>c(H+)
D. Va与Vb任意比时:c(K+)+c(H+)=c(OH-)+c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
检验实验室淀粉水解产物及水解是否完全所选用的试剂是( )
A.碘水,含NaOH的Cu(OH)2悬浊液
B. KI淀粉溶液,含NaOH的Cu(OH)2悬浊液
C.NaOH溶液,银氨溶液或含NaOH的Cu(OH)2悬浊液,碘水
D.溴水,碘水,银氨溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
可以由下列反应合成三聚氰胺:CaO+3C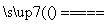 CaC2+CO↑,
CaC2+CO↑,
CaC2+N2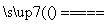 CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,
CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,
NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:_____ ;CaCN2中阴离子为CN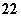 ,与CN
,与CN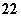 互为等电子体的
互为等电子体的
分子有N2O和________(填化学式),由此可以推知CN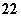 的空间构型为______ __。
的空间构型为______ __。
(2)尿素分子中C原子采取________杂化。
(3)三聚氰胺( )俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 (
)俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 (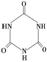 )后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
)后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
(4)CaO晶胞如图所示,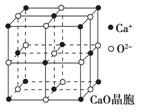 CaO晶体中Ca2+的配位数为 ,
CaO晶体中Ca2+的配位数为 ,
Ca2+采取的堆积方式为 ,
O2-处于Ca2+堆积形成的 空隙中;
CaO晶体和NaCl晶体的晶格能分别为:CaO 3401 kJ·mol-1、NaCl 786 kJ·mol-1。导致两者晶格能差异的主要原因是___________________________________。
(5)配位化合物K3[Fe(CN)n]遇亚铁离子会产生蓝色沉淀,因此可用于检验亚铁离子,已知铁原子的最外层电子数和配体提供电子数之和为14,求n= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com