
25℃时,向10 mL 0.01 mol/L KOH溶液中滴加0.01 mol/L苯酚溶液,混合溶液中粒子浓度关系正确的是
A. pH>7时,c(C6H5O-)>c(K+)>c(H+)>c(OH―)
B. pH<7时,c(K+)>c(C6H5O-)> c(H+)>c(OH―)
C. V[C6H5OH(aq)]=10mL时,c(K+)=c(C6H5O-)>c(OH―)=c(H+)
D. V[C6H5OH(aq)]=20mL时,c(C6H5O-) + c(C6H5OH) = 2c(K+)
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
X、Y、Z三种短周期元素在周期表中的位置如右图所示,Y原子的最外层电子数是次外层电子数的3倍,下列说法正确的是
A.气态氢化物的沸点:Z<Y B.Z元素的氧化物对应的水化物一定是一种强酸
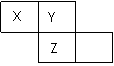 C.三种元素原子半径的大小顺序为: X>Y>Z X Y
C.三种元素原子半径的大小顺序为: X>Y>Z X Y
D.Z单质与Fe反应生成的化合物中,铁元素显+3价 Z
查看答案和解析>>
科目:高中化学 来源: 题型:
2013年l月我国大部分地区被雾霾笼罩,1月12日北京PM2.5指数濒临“爆表”,空气质量持续六级严重污染。PM2.5是指大气中直径小于或等于2.5微米(2.5×10-6m)的细小颗粒物,也称为可入肺颗粒物。下列有关说法中错误的是( )
A.大雾的形成与汽车的尾气排放有一定的关系
B.微粒直径为2. 5微米的细小颗粒物与空气形成的分散系属于胶体
C.实施绿化工程,可以有效地防治PM2.5污染
D.PM2.5表面积大,能吸附大量的有毒、有害物质
查看答案和解析>>
科目:高中化学 来源: 题型:
正在火星上工作的美国“勇气号”“机遇号”探测车的一个重要任务就是收集有关Fe2O3及硫酸盐的信息,以证明火星上存在或曾经存在过H2O。以下叙述正确的是( )
A.硫酸盐都易溶于水
B.检验红砖中的红色物质是否是Fe2O3的操作步骤为:样品―→粉碎―→加水溶解―→过滤―→向滤液中滴加KSCN溶液
C.分别还原a mol Fe2O3所需H2、Al、CO物质的量之比为3∶2∶3
D.明矾含有结晶水,是混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
请将下列5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3,分别填入下面对应的横线上,组成一个化学方程式并配平。
⑴.□ + □ = □ + □ + □ +□H2O
⑵.反应物中发生氧化反应的物质 ,被还原的元素是 。
⑶.反应中1mol氧化剂 (填“得到”或“失去”) mol电子。
⑷.HNO3在上述反应中表现出来的性质是 。(填选项编号)
A.酸性 B.氧化性 C.还原性 D.热不稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以A1作阳极、pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:
电池:Pb(s) + PbO2(s) + 2H2SO4(aq) = 2PbSO4(s) + 2H2O(l)
电解池:2Al+3H2O  Al2O3+3H2↑
Al2O3+3H2↑
电解过程中,以下判断正确的是
| 电池 | 电解池 | |
| A | H+移向Pb电极 | H+移向Pb电极 |
| B | 每消耗3 mol Pb | 生成2 mol Al2O3 |
| C | 正极:PbO2 + 4H+ + 2e- = Pb2+ + 2H2O | 阳极:2Al + 3H2O-6e- = Al2O3 + 6H+ |
| D |
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下将稀NaOH溶液和稀CH3COOH溶液混合,不可能出现的结果是:
A.pH>7,且c(OH—)>c(Na+)> c(H+)>c(CH3COO—)
B .pH>7,且c(Na+)+c(H+)=c(CH3COO—)+c(OH—)
C .PH<7,且c(CH3COO—)>c(H+)>c(Na+)>c(OH—)
D .pH=7,且c(CH3COO—)>c(Na+)>c(H+)=c(OH—)
查看答案和解析>>
科目:高中化学 来源: 题型:
 正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小。某实验小组利用如下装置合成正丁醚(其它装置均略去),发生的主要反应为:
正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小。某实验小组利用如下装置合成正丁醚(其它装置均略去),发生的主要反应为:




实验过程如下:在容积为100mL 的三颈烧瓶中将5 mL浓硫酸、14.8g正丁醇和几粒沸石混合均匀,再加热回流一段时间,收集到粗产品,精制得到正丁醚。回答下列问题:
(1)合成粗产品时,液体试剂加入顺序是 。
(2)实验中冷凝水应从 口出去(填“a”或“b”)。
(3)为保证反应温度恒定在135℃,装置C中所盛液体必须具有的物理性质为 。
(4)加热时间过长或温度过高,反应混合液会变黑,写出用NaOH溶液吸收有毒尾气的离子方程式 。
(5)得到的正丁醚粗产品依次用8 mL50%的硫酸、10 mL水萃取洗涤。该步骤中需要的属于硅酸盐材质的实验仪器是烧杯、玻璃棒、 。该仪器使用前需要 。
(6)将分离出的有机层用无水氯化钙干燥,过滤后再进行 (填操作名称)精制得到正丁醚。
(7)本实验最终得到6.50g正丁醚,则正丁醚的产率是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关原子结构和元素周期律表述正确的是
①原子序数为15的元素的最高化合价为+3
②ⅦA族元素是同周期中非金属性最强的元素
③第二周期ⅣA族元素的原子核电荷数和中子数一定为6
④原子序数为12的元素位于元素周期表的第三周期ⅡA族
A.①② B.①③ C.②④ D.③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com