
下面是生产生活中的常见有机物的分子式、结构式、结构简式或名称有关说法正确的是( )
①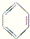 ②
②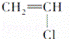 ③
③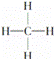 ④
④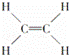 ⑤CH3CH2OH
⑤CH3CH2OH
⑥C6H12O6 ⑦CH3COOH ⑧硬脂酸甘油酯 ⑨蛋白质 ⑩聚乙烯
A.能跟溴的四氯化碳溶液发生加成反应并使之褪色的有①②④⑩
B.投入钠能产生H2的是⑤⑦⑧⑨
C.属于高分子材料的是⑧⑨⑩
D.含碳量最高、有毒、常温下为液体且点燃时有浓烟的是①
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案科目:高中化学 来源: 题型:
下列物质的化学用语表达正确的是( )
A.甲烷的球棍模型:
B.(CH3)3COH的名称:2,2二甲基乙醇
C.乙醛的结构式:CH3CHO
D.羟基的电子式: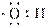
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中错误的是( )
A.质子数相同的原子,其核外电子排布也相同
B.质量数相同的不同原子,其化学性质一定相同
C.金属性越强,其原子在反应中越易失去电子
D.非金属性越强,其阴离子越难失去电子
查看答案和解析>>
科目:高中化学 来源: 题型:
有四种化合物W、X、Y、Z,它们都是由短周期元素A、B、C、D、E中的两种元素组成的。已知:
(a)A、B、C、D、E五种元素的原子序数依次增大,且A、D同主族,C、E同主族,B、C同周期。
(b)W由B、C组成,分子中原子个数比为B:C=1:2,固体易升华。
(c)X由A、C组成,分子中原子个数比为A:C=1:1。
(d)Y由C、D形成的离子化合物,且Y中相应元素的微粒之比为:C:D=1:1。
(e)Z是由D、E形成的离子化合物,其中阳离子比阴离子少一个电子层,阴、阳离子数之比为1:2。
试回答下列各小题:
⑴各元素符号:A B C D E
⑵W的电子式: 。
⑶X的结构式: 。
⑷Y的电子式: 。
⑸Z的化学式: 。
⑹写出Y与水反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述及评价均合理的是( )
| 选项 | 叙述 | 评价 |
| A | 乙酸乙酯在H218O中水解,产物乙醇中将含有18O | 错,根据酯的水解规律,产物乙酸中将含有18O同位素,而乙醇则没有。 |
| B | 淀粉与20%的硫酸混合溶液在沸水浴中充分加热后滴加碘水无蓝色现象,则说明淀粉水解完全 | 错,淀粉水解后未加碱中和至溶液呈碱性。 |
| C | 向卤代烃水解后的溶液中加入AgNO3溶液,根据沉淀颜色可以判断卤素原子种类 | 对,水解后溶液中有卤化氢,与AgNO3溶液反应生成卤化银沉淀。 |
| D | 可以用新制的Cu(OH)2悬浊液鉴别乙醇溶液、乙酸溶液和葡萄糖溶液 | 错,用新制的Cu(OH)2悬浊液不能鉴别乙醇溶液和乙酸溶液。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
化学科学需要借助化学专用语言描述,下列有关化学用语正确的是
A.CO2的电子式: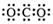 B.Cl-的结构示意图:
B.Cl-的结构示意图: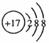
C.乙醇的结构式:CH3CH2OH D.乙烯的结构简式:CH2CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
铁镍蓄电池,放电时的总反应为Fe+Ni2O3+3H2O==Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是
A.电池的电解液为碱性溶液,负极为Fe
B.电池放电过程中,正极附近溶液的pH增大
C.电池放电时,电解质溶液中OH-移向正极
D.电池放电时,负极反应为Fe+2OH--2e-==Fe(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
硅及其化合物在自然界广泛存在并被人类应用。
(1)氮化硅膜与二氧化硅膜相比较具有表面化学性能稳定等优点,故氮化硅膜可用于半导体工业。可以用NH3和SiH4(硅烷)在一定条件下反应,并在600 T的加热基板上生成氮化硅膜:
3SiH4+4NH3 Si3N4+12H2
Si3N4+12H2
以硅化镁为原料制备硅烷的反应和工业流程如下:
反应原理:4NH4Cl+Mg2Si 4NH3↑+SiH4↑+2MgCl2 (ΔH<0)
4NH3↑+SiH4↑+2MgCl2 (ΔH<0)

①NH4Cl中的化学键类型有______________________,SiH4的电子式为______________。
②上述生产硅烷的过程中液氨的作用是____________________ _________________________________________________________。
 ③氨气是重要的工业原料,写出氨气发生催化氧化反应生成NO的化学方程式______________________,
③氨气是重要的工业原料,写出氨气发生催化氧化反应生成NO的化学方程式______________________,
实验室可利用如右图所示装置完成该反应。在实验过程中,除观察到锥形瓶中产生红棕色气体外,还可观察到有白烟生成,白烟的主要成分是______________。
(2)三硅酸镁(Mg2Si3O8·nH2O)难溶于水,在医药上可做抗酸剂。它除了可以中和胃液中多余的酸之外,生成的H2SiO3还可覆盖在有溃疡的胃表面,保护其不再受刺激。三硅酸镁与盐酸反应的化学方程式为__________________ _________________________________________。将0.184 g三硅酸镁加入到50 mL 0.1 mol·L-1盐酸中,充分反应后,滤去沉淀,用0.1 mol·L-1 NaOH溶液滴定剩余的盐酸,消耗NaOH溶液30 mL,则Mg2Si3O8·nH2O中的n值为________。(注:Mg2Si3O8的摩尔质量为260 g·mol-1)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com