
在密闭容器中,加热等物质的量的NaHCO3和Na2O2的固体混合物,充分反应后,容器中的固体剩余物是
A.Na2CO3和Na2O2 B.Na2CO3和NaOH
C.NaOH和Na2O2 D.NaOH、Na2O2和Na2CO3
B
【解析】
试题分析:设Na2O2固体和NaHCO3固体都为1mol,则
2NaHCO3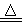 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
2mol 1mol 1mol 1mol
1mol 0.5mol 0.5mol 0.5mol
2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑
0.5mol 0.5mol 0.5mol 0.5mol 0.5mol 1mol
则剩余固体为n(Na2CO3)=0.5mol+0.5mol=1mol、n(NaOH)=1mol
即剩余固体是等物质的量的Na2CO3和 NaOH的混合物,故选B。
考点:考查钠的化合物的性质以及根据方程式进行的计算


科目:高中化学 来源:2014-2015学年浙江省等四校高三上学期期中联考化学试卷(解析版) 题型:填空题
(13分)对含氮物质的研究和利用有着极为重要的意义。
(1)N2、O2和H2相互之间可以发生化合反应,已知反应的热化学方程式如下:
N2(g)+O2(g)=2NO(g) 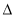 H= +180.5kJ·mol-1;
H= +180.5kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) 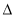 H = -483.6 kJ·mol-1;
H = -483.6 kJ·mol-1;
N2(g)+3H2(g)=2NH3(g) 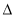 H = -92.4 kJ·mol-1。
H = -92.4 kJ·mol-1。
则氨的催化氧化反应的热化学方程式为 。
(2)汽车尾气净化的一个反应原理为:
2NO(g)+2CO(g) N2(g)+2CO2(g)
N2(g)+2CO2(g)  H<0。一定温度下,将2.8mol NO、2.4mol CO通入固定容积为2L的密闭容器中,反应过程中部分物质的物质的量变化如图所示。
H<0。一定温度下,将2.8mol NO、2.4mol CO通入固定容积为2L的密闭容器中,反应过程中部分物质的物质的量变化如图所示。

①NO的平衡转化率为 ,0~20min平均反应速率v(NO)为 。25min时,若保持反应温度不变,再向容器中充入CO、N2各0.8 mol,则化学平衡将 移动(填“向左”、“向右”或“不”)。
②若只改变某一反应条件X,反应由原平衡I达到新平衡II,变量Y的变化趋势如下图所示。下列说法正确的是 (填字母代号)。

(3)某化学小组拟设计以N2和H2为电极反应物,以HCl—NH4Cl为电解质溶液制成燃料电池,则该电池的正极反应式为 。假设电解质溶液的体积不变,下列说法正确的是 (填字母代号)。
a.放电过程中,电解质溶液的pH保持不变
b.溶液中的NH4Cl浓度增大,但Cl-离子浓度不变
c.每转移6.02×1023个电子,则有标准状况下11.2L电极反应物被氧化
d.为保持放电效果,电池使用一段时间需更换电解质溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列关于C、Si、S、Cl四种非金属元素的说法中,正确的是
A.在自然界中都能以游离态存在
B.两两结合形成的化合物都是共价化合物
C.氢化物的热稳定性比较:CH4 < SiH4 < H2S < HCl
D.最高价氧化物都能与水反应生成相应的酸,且酸性依次增强
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省高三上学期第二次模考试化学试卷(解析版) 题型:选择题
有一无色溶液,可能含有K+、Al3+、Mg2+、 NH4+ 、Cl-、SO42-、HCO3—、MnO4—中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量的Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断正确的是
A.肯定有Al3+、Mg2+、NH4+、Cl- B.肯定有Al3+、Mg2+、HCO3—
C.肯定有K+、HCO3—、MnO4— D.肯定有Al3+、Mg2+、SO42-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省高三上学期第二次模考试化学试卷(解析版) 题型:选择题
下列相关离子方程式书写正确的是
A.NaClO溶液与FeCl2溶液混合:6Fe2++3ClO-+3H2O===2Fe(OH)3↓+3Cl-+4Fe3+
B.用食醋检验牙膏中的碳酸钙:CaCO3+2H+===Ca2++CO2↑+H2O
C.FeCl2酸性溶液放在空气中变质:2Fe2++4H++O2===2Fe3++2H2O
D.电解MgCl2水溶液的离子方程式:2Cl-+2H2O H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高三上学期期中化学试卷(解析版) 题型:实验题
(6分)某氮肥NH4HCO3中混有少量(NH4)2CO3,现采用下列方案测定该氮肥中(NH4)2CO3的质量分数:称取5.7 g上述样品与2.0 mol/L NaOH溶液混合,完全溶解后,低温加热使其充分反应(该温度下铵盐不分解),并使生成的氨气全部被硫酸吸收,测得氨气的质量与所用NaOH溶液体积的关系如图所示:
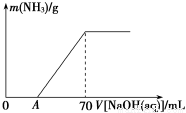
(1)A点前样品与NaOH反应的离子方程式为__________________________________
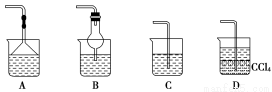
(2)为使生成的氨气被硫酸吸收时不发生倒吸,可以选用下列装置中的________。
(3)样品中(NH4)2CO3的质量分数是________%(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高三上学期期中化学试卷(解析版) 题型:选择题
实验室需480 mL 1.0 mol/L的NaOH溶液,假如其他操作均是准确无误的,下列情况会引起配制溶液的浓度偏高的是:
A.称取氢氧化钠20.0 g
B.定容时俯视观察刻度线
C.移液时,对用于溶解氢氧化钠的烧杯没有进行冲洗
D.移液用玻璃棒引流时,玻璃棒下端靠在容量瓶刻度线上方
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省赣州市十二县高三上学期期中化学试卷(解析版) 题型:填空题
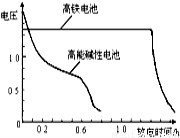
(10分)高铁酸钾(K2FeO4)具有很强的氧化性,是一种新型的高效水处理剂。
(1)高铁酸钾具有强氧化性的原因是 。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为 ,___ _ _____。
(3)制备K2FeO4可以采用干式氧化法或湿式氧化法。
①干式氧化的初始反应是2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中每生成2 mol Na2FeO4时转移电子 mol。
②湿式氧化法的流程如下图:
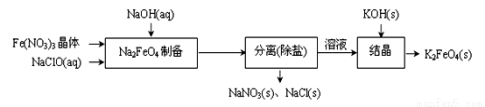
上述流程中制备Na2FeO4的化学方程式是: 。
(4)高铁电池是正在研制中的可充电电池,下图为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com