
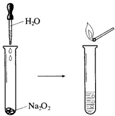
 Na2O2����ǿ�����ԣ���������Ư��֯����Ʒ����ˡ���ά�ȣ�
Na2O2����ǿ�����ԣ���������Ư��֯����Ʒ����ˡ���ά�ȣ����� ��1��Na2O2�У����û��ϼ۴�����Ϊ0��ԭ���ɻ�������NaԪ��Ϊ+1�ۣ����㻯������OԪ�صĻ��ϼۣ�
��2���������ƺ�ˮ��Ӧ�����������ƺ����������ݻ�ѧ��Ӧ�IJ�����ȷ���������������м��ԣ���ʹ��̪��ʾ��ɫ���Ҳ�����������ɫ��ȥ��
��3���������ƺ�ˮ�Լ�������̼��Ӧ������������������ÿ����1mol������ת��2mol���Ӽ���������5.6L O2��ת�Ƶ��ӵ����ʵ�����
��� �⣺��1������+1�ۣ��軯����Na2O2��OԪ�ػ��ϼ�Ϊx�����ݻ������и�Ԫ�ػ��ϼ۴�����Ϊ�㣬��+1����2+2x=0�����x=-1��
�ʴ�Ϊ��-1��
��2���������ƺ�ˮ��Ӧ�����������ƺ���������2Na2O2+2H2O=4NaOH+O2�������Թ�������Һ�еμӷ�̪��Һ����ϵ�ʼ��ԣ���Һ��죬�������������������ԣ��ʽ���ҺƯ�ף����������Ǿ��ҷ�Ӧ���������ݣ��Թܿڴ����ǵ�ľ����ȼ��
�ʴ�Ϊ�����ҷ�Ӧ���������ݣ��Թܿڴ����ǵ�ľ����ȼ��2Na2O2+2H2O=4NaOH+O2�����ȱ�����ɫ��
��3����Ϊ�������ƺ�ˮ�Լ�������̼��Ӧ������������������������ȼ�ԣ��������ƺͶ�����̼��Ӧ����̼���ƺ���������2Na2O2+2CO2=2Na2CO3+O2����ÿ����1mol������ת��2mol���ӣ���������$\frac{5.6L}{22.4L/mol}$=0.25mol����ת��0.5mol���ӣ�
�ʴ�Ϊ��2Na2O2+2CO2=2Na2CO3+O2����0.5��
���� ���⿼����ʵ����ʽ����������ƵĻ�ѧ���ʣ�Ϊ�߿��������ͣ�������ѧ���ķ��������Ŀ��飬���չ���������ˮ���������̼��Ӧ�ǽ��ؼ�����Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | HCl | B�� | CO2 | C�� | NH3 | D�� | CO |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �뾶��Y2-��Z-��X+��W3+ | B�� | ��ԭ�ԣ�Y2-��Z- | ||
| C�� | �����ԣ�W3+��X+ | D�� | ��������c��d��b��a |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 28 g C2H4�������õ��Ӷ���ĿΪ4NA | |
| B�� | 1 L 0.1 mol•L-1������Һ��H+��Ϊ0.1NA | |
| C�� | 1 mol�����������������Ϊ10NA | |
| D�� | ��״���£�22.4 L�Ҵ��ķ�����ΪNA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
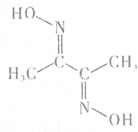 �����ܡ����Ƚ������仯�����ڹ�ҵ������Ҫ��;����ش�
�����ܡ����Ƚ������仯�����ڹ�ҵ������Ҫ��;����ش��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | ���� |
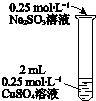 | i �л�ɫ�������֣����� Na2SO3��Һ�ĵ��룬�������ӣ����ӵ�5mLʱ����Һ����ɫ��ʧ�� ii ���Թܼ��ȣ���ɫ������Ϊש��ɫ���д̼�����ζ��������� iii�ڼ��������£���������Na2SO3��Һ��ש��ɫ�������٣���1�ӵ�10mLʱ��������ȫ�ܽ⣬����ɫ��Һ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | a+2b-c | B�� | a+b-2c | C�� | 2a+2b-c | D�� | a+2b-2c |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
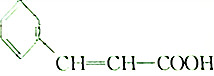
| A�� | ����������Na������Ӧ����H2 | B�� | �������ܷ����Ӿ۷�Ӧ | ||
| C�� | ��������һ�����¿ɷ���������Ӧ | D�� | ���ʵ�Ħ������Ϊ148 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 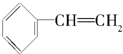 | B�� | 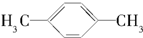 | C�� | 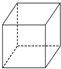 | D�� |  |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com