
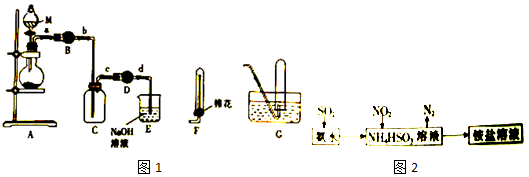
分析 由实验目的和实验装置可知,因Fe在浓硝酸中会发生钝化,不用铁屑,A中可用铜和浓硝酸反应制备二氧化氮,Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O所以装置A中的分液漏斗中盛装的液体是浓硝酸,干燥管B、D中只能盛装固体干燥剂,因碱石灰与二氧化氮反应,所以选择无水氯化钙或五氧化二磷,干燥管D中干燥剂的作用是防止E装置中的水蒸气进入集气瓶C中,E装置为尾气处理装置,且一氧化氮难溶于水,易与氧气反应,则收集NO选排水法,以此来解答.
(1)根据常见仪器的名称分析解答;
(2)干燥管B盛装固体干燥剂,干燥二氧化氮;
(3)E中二氧化氮在碱性条件下发生歧化反应;
(4)一氧化氮难溶于水,易与氧气反应,则收集NO选排水法;
(5)①化合价升高元素所在的反应物是还原剂,化合价降低元素所在的反应物是氧化剂;
②根据硫原子守恒以及根据方程式4NH4HSO3+2NO2=N2+4NH4HSO4计算.
解答 解:(1)仪器M为带有玻璃活塞的漏斗,A中可用铜和浓硝酸反应制备二氧化氮,Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,所以装置A盛装的液体是浓硝酸,该仪器名称为分液漏斗,
故答案为:分液漏斗;
(2)二氧化氮是酸性气体,不能用碱性干燥剂,所以不能选碱石灰,干燥管B中只能盛装固体干燥剂,所以不能选浓硫酸,只能选无水氯化钙或五氧化二磷,
故答案为:无水氯化钙或五氧化二磷;
(3)反应物NO2中氮元素的化合价是+4价,发生歧化反应,N元素化合价最高的含氮化合物是NaNO3,根据氧化还原反应的原理知,则氮元素的化合价是+3价的产物为NaNO2,结合同一化学反应方程式中各元素的原子守恒可知,该反应的方程式为:2NO2+2NaOH=NaNO3+NaNO2+H2O,
故答案为:2NO2+2NaOH=NaNO3+NaNO2+H2O;
(4)一氧化氮为无色难溶于水密度与空气接近的气体,所以用排水法收集NO,选择装置G,
故答案为:G;
(5)①NO2与NH4HSO3反应,+4价的氮氧化+4价的硫,反应的方程式为:4NH4HSO3+2NO2=N2+4NH4HSO4,氮的化合价降低,NO2为氧化剂,硫化合价升高,NH4HSO3为还原剂,所以氧化剂与还原剂的物质的量之比=2:4=1:2,
故答案为:1:2;
②废气中SO2的体积分数为1.5%,某工厂用该方法处理22.4m3时该废气,含有二氧化硫的物质的量为22.4×103L×1.5%÷22.4L/mol=15mol,根据硫原子守恒n(SO2)=n(NH4HSO3)
,4NH4HSO3+2NO2=N2+4NH4HSO4,生成N2的物质的量为n(N2)=$\frac{1}{4}$n(NH4HSO3)=15mol×$\frac{1}{4}$,生成N2体积为V=nvm=15mol×$\frac{1}{4}$×22.4L/mol=84L,
故答案为:84L.
点评 本题考查物质的制备、性质实验,为高频考点,把握二氧化氮的制备原理、实验装置的作用为解答的关键,侧重分析与实验能力的考查,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
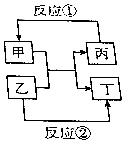 物质甲、乙、丙、丁的相互转化关系如图所反应所示(部分反应物、产物及反应条件已略去),已知甲为常见金属(Na、Mg、Al、Fe、Cu)或其氧化物.回答下列间题:
物质甲、乙、丙、丁的相互转化关系如图所反应所示(部分反应物、产物及反应条件已略去),已知甲为常见金属(Na、Mg、Al、Fe、Cu)或其氧化物.回答下列间题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 再滴加AgNO3溶液,观察是否有AgI沉淀产生 | |
| B. | 加入CCl4振荡后,观察下层液体颜色 | |
| C. | 加入CCl4振荡后,取上层清液,滴加KSCN溶液,观察是否出现红色 | |
| D. | 加入CCl4振荡后,取上层清液,滴加入AgNO3溶液,观察是否有AgCl沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20gD2O中含有的中子数为10NA | |
| B. | 0.1molCl2与足量的NaOH溶液反应,转移的电子数为0.2NA | |
| C. | 常温下,pH=13 的NaOH溶液中含有的OH-数为0.1NA | |
| D. | 标准状况下,11.2LCCl4中含有C-Cl键的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ②③④⑥ | C. | ②④⑤ | D. | ③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 铜与稀硝酸反应产生NO,NO又被氧化成NO2,对实验观察无色NO有干扰,过多的NO、NO2又会污染环境,改进实验的涉及符合绿色化学的思想.有兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”的实验,以探究化学实验的绿色化.
铜与稀硝酸反应产生NO,NO又被氧化成NO2,对实验观察无色NO有干扰,过多的NO、NO2又会污染环境,改进实验的涉及符合绿色化学的思想.有兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”的实验,以探究化学实验的绿色化.| 方案 | 反应物 |
| 甲 | Cu、浓硝酸 |
| 乙 | Cu、稀硝酸 |
| 丙 | Cu、O2、稀硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+ | B. | Fe2+ | C. | Fe3+ | D. | Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图的框图是利用海水和海边贝壳为原料设计的制备漂白粉的工艺流程.分析图示各物质的关系,然后回答问题.
如图的框图是利用海水和海边贝壳为原料设计的制备漂白粉的工艺流程.分析图示各物质的关系,然后回答问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com