
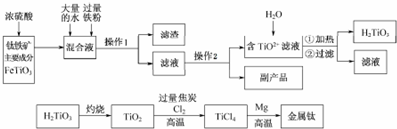
分析 用浓硫酸处理钛铁矿,并向所得溶液中加入大量水稀释后加入过量铁粉还原铁离子,过滤得到滤液通过蒸发浓缩,冷却结晶,过滤得到TiO2+滤液,和副产品FeSO4,滤液中加入水加热过滤得到H2TiO3,H2TiO3加热灼烧得到TiO2,加入氯气、过量碳高温加热反应生成TiCl4和一氧化碳,四氯化钛和金属镁高温加热反应得到氯化镁和钛金属.
(1)操作1为过滤,操作2的实验步骤为:蒸发浓缩、冷却结晶,加入过量铁屑后溶液中含有Fe2+离子,依据原子守恒可知产物为硫酸亚铁,则过滤后可得FeSO4•7H2O(或FeSO4),滤渣为过量的铁屑和不溶物脉石;
(2)依据溶液中存在平衡:TiO2++2H2O?H2TiO3+2H+,平衡影响因素和平衡移动原理分析判断;
(3)根据金属铝的氧化物的性质结合信息来回答,金属钠的活泼性强,可以用于金属的冶炼;
(4)根据电解原理:阴极上是发生得电子的还原反应;
(5)准确滴加氯化铁溶液可使用酸式滴定管;根据元素守恒计算待测钛液中TiOSO4的物质的量.
解答 解:(1)操作1为过滤用到的玻璃仪器除烧杯外还有漏斗、玻璃棒,操作2的实验步骤为:蒸发浓缩、冷却结晶,加入过量铁屑后溶液中含有Fe2+离子,则过滤后可得FeSO4•7H2O(或FeSO4),副产品主要成分的化学式为FeSO4,故答案为:漏斗、玻璃棒;蒸发浓缩、冷却结晶;FeSO4;
(2)加热的目的是促进TiO2+水解生成H2TiO3,分离出固体加热得到TiO2;溶液中存在平衡:TiO2++2H2O?H2TiO3+2H+,当加热升温后,
平衡正向移动,生成H2TiO3;
故答案为:溶液中存在平衡:TiO2++2H2O?H2TiO3+2H+,当加热升温后,平衡正向移动,生成H2TiO3;
(3)钛的还原性介于铝与锌之间,氧化铝是一层致密的氧化膜,估计钛能耐腐蚀的原因钛表面形成一层致密的氧化膜(或钛的内部结构紧密);活泼金属钠可以将金属钛置换出来:TiCl4+4Na$\frac{\underline{\;高温\;}}{\;}$Ti+4NaCl,Zn、和Fe都是不可以的,活泼性差,
故答案为:钛表面形成一层致密的氧化膜(或钛的内部结构紧密);TiCl4+4Na$\frac{\underline{\;高温\;}}{\;}$Ti+4NaCl;
(4)因TiO2作阴极,得到电子,被还原,TiO2 +4e-=Ti+2O2-,得到单质Ti,
故答案为:TiO2 +4e-=Ti+2O2-;
(5)准确滴加氯化铁溶液可使用滴定管,氯化铁有较强的氧化性,应用酸式滴定管;
设滤液Ti3+的物质的量为X.
Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
1 1
X 0.1000mol•L-1×0.03L
解得X=0.1000mol•L-1×0.03L=0.003mol
则待测钛液中TiOSO4的物质的量=0.003mol×5=0.015mol
根据C=$\frac{n}{V}$=$\frac{0.015mol}{0.01L}$=1.50 mol•L-1
故答案为:酸式滴定管;1.50 mol•L-1.
点评 本题以框图推断的形式结合化学实验和元素化合物的相关知识考查学生的阅读、分析、提取信息解决问题的能力,主要是化学工艺流程,题目难度较大,做题时注意从物质的性质角度结合题中信息解答.


科目:高中化学 来源: 题型:选择题
| A. | 在食盐中加入碘 | B. | 在自来水中加入碘 | ||
| C. | 在饮料中加入碘 | D. | 在饮用酒中加入碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
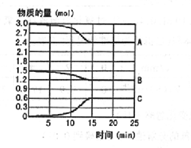 在600℃时,将一定量的SO2和O2充入一个容积固定为2L的密闭容器中,反应过程中各种物质的量随时间的变化如图所示.
在600℃时,将一定量的SO2和O2充入一个容积固定为2L的密闭容器中,反应过程中各种物质的量随时间的变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应属于分解反应 | |
| B. | 上述反应瞬间产生大量高温气体推动航天飞机飞行 | |
| C. | 反应从能量变化上说,主要是化学能转变为热能和动能 | |
| D. | 在反应中高氯酸铵只能起氧化剂作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度 | B. | 增大压强 | C. | 减小反应物浓度 | D. | 增大反应物浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
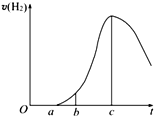 把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示,回答下列问题:
把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com