
钢铁工业对促进经济和社会发展起了重要作用。
(1)炼铁高炉分为五部分,铁矿石与高温煤气主要在________部分发生反应,在________部分开始生成生铁和炉渣。
(2)炼钢时,除磷的化学方程式为:_____________;
加入硅、锰和铝的目的是____________。
(3)不锈钢含有的 Cr 元素是在炼钢过程的氧吹________(填“前”或“后”)加入,原因是_________________。
(4)炼铁和炼钢生产中,尾气均含有的主要污染物是________。从环保和经济角度考虑,上述尾气经处理可用作_____。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
标准状况下,6.72 L NO2通入水后,收集到5.04 L气体,则被氧化的NO2的体积是( )
A.1.68 L B.2.52 L C.0.56 L D.1.12 L
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨的流程示意图如下:

回答下列问题:
(1)工业合成氨的原料是氮气和氢气。氮气是从空气中分离出来的,通常使用的两种分离方法是________、________;氢气的来源是水和碳氢化合物,写出分别采用煤和天然气为原料制取氢气的化学方程式_______________________。
(2)设备A中含有电加热器,触媒和热交换器,设备A的名称是________,其中发生的化学反应方程式为____________。
(3)设备B的名称为________,其中m和n是两个通水口,入水口是________(填“m”或“n”)。不宜从相反方向通水的原因是______________。
(4)设备C的作用是______________________。
(5)在原料气制备过程中混有的CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:
CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
已知1 000 K时该反应的平衡常数K=0.627,若要使CO的转化率超过90%,则起始物中c(H2O)∶c(CO)不低于________。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学是人类进步的关键,化学为人类的生产、生活提供了物质保证。
(1)电镀时,用镀层金属作阳极的作用是____________________________________。为了使镀层厚度均匀、光滑致密、与镀件的附着力22____。
(2)卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品。从卤水中提取镁的步骤为
a.将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳;
b.将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;
c.在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液,再经蒸发结晶得到MgCl2·6H2O;
d.将MgCl2·6H2O在一定条件下加热得到无水MgCl2;
e.电解熔融的氯化镁可得到Mg。
①步骤d中的“一定条件”指的是__________________,目的是_________________。
②上述提取镁的流程中,为了降低成本,减少污染,可以采取很多措施,请写出其中一点________________________________________________________________________。
③有同学认为:步骤b后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化实验步骤,你同意该同学的想法吗?为什么?
(3)铀是核反应最重要的燃料,已经研制成功一种螫合型离子交换树脂,它专门吸附海水中的U4+,而不吸附其他元素。其反应原理为____________________________________
________________________________________________________________________(树脂用HR代替),
发生离子交换后的离子交换膜用酸处理还可再生并得到含铀的溶液,其反应原理为________________________________________________________________________
________________________________________________________________________。
(4)阿司匹林(COOHOOCCH3) 在潮湿空气中可分解成水杨酸和醋酸而略带酸臭味,故密封保存,用化学方程式表示阿司匹林必须贮藏于密闭、干燥处的原因:______________
在潮湿空气中可分解成水杨酸和醋酸而略带酸臭味,故密封保存,用化学方程式表示阿司匹林必须贮藏于密闭、干燥处的原因:______________
________________________________________________________________________,
此反应的类型属于________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
海水是宝贵的自然资源,从海水中可以提取多种化工原料,如图是某工厂对海水综合利用的示意图:
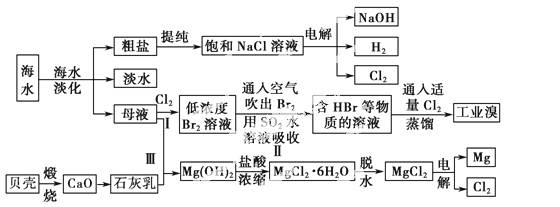
(1)在粗盐中含有Ca2+、Mg2+、SO等杂质,电解精制时所用的试剂有①盐酸;②氯化钡溶液;③氢氧化钠溶液;④碳酸钠溶液。则加入试剂的先后顺序是____________(填编号)。
(2)工业上电解饱和食盐水的离子方程式:_________。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是____________ _____。
_____。
步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式:_____________________。
(4)从步骤Ⅲ得到的Mg(OH)2沉淀中混有少量的Ca(OH)2,除去少量Ca(OH)2的方法是向沉淀中加入________溶液,充分搅拌后经________(填操作方法)可得纯 净的Mg(OH)2。
净的Mg(OH)2。
(5)在制取无水氯化镁时需要在干燥的HCl气流中加热MgCl2·6H2O的原因:______________________。
(6)电解无水氯化镁所得的镁蒸气在特定的环境里冷却后即为固体镁,下列物质中可以用作镁蒸气冷却剂的是________(填序号)。
A.H2 B.CO2 C.空气 D.O2 E.水蒸气
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用重铬酸钠(Na2Cr2O7)结晶后的母液(含少量杂质Fe3+)生产重铬酸钾(K2Cr2O7)。工艺流程及相关物质溶解度曲线如图
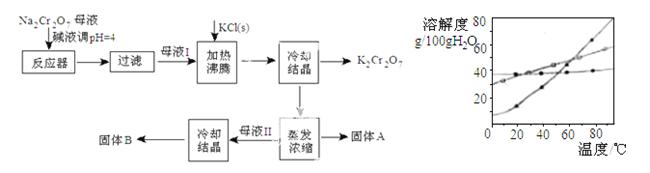 (1)由Na2Cr2O7生产K2Cr2O7的化学方程式为
(1)由Na2Cr2O7生产K2Cr2O7的化学方程式为  。通过冷过结晶析出大量K2Cr2O7的原因是 。
。通过冷过结晶析出大量K2Cr2O7的原因是 。
(2)向Na2Cr2O7母液中加碱液调pH的目的是 。
(3)固体A主要为 (填化学 式)
式) ,固体B主要为 (填化学式)。
,固体B主要为 (填化学式)。
(4)用热水洗涤固体A,回收的洗涤液转移到母液 (填“I”“II”或“III”)中,既能提高产率又可使能耗最低。
查看答案和解析>>
科目:高中化学 来源: 题型:
美国科学家理查德·海克和日本科学家根岸英一、铃木彰因在研发“有机合成中的钯催化的交叉偶联”而获得2010年度诺贝尔化学奖。有机合成常用的钯/活性炭催化剂,长期使用催化剂会被杂质(如:铁、有机物等)污染而失去活性,成为废催化剂,需对其再生回收。一种由废催化剂制取氯化钯的工艺流程如下:
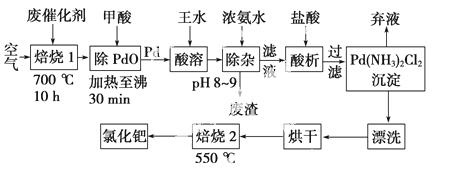
(1)废钯催化剂经烘干后,再在700 ℃的高温下焙烧,焙烧过程中需通入足量空气的原因是________________________________________________________________________;
甲酸还原氧化钯的化学方程式为____________________ ______________________。
______________________。
(2)钯在王水(浓硝酸与浓盐酸按体积比1∶3)中转化为H2PdCl4,硝酸还原为NO,该反应的化学方程式为______________________。
(3)钯精渣中钯的回收率高低主要取决于王水溶解的操作条件,已知反应温度、反应时间和王水用量对钯回收率的影响如下图1~图3所示,则王水溶解钯精渣的适宜条件(温度、时间和王水用量)为__________、__________、__________。

(4)加浓氨水时,钯转变为可溶性[Pd(NH3)2]2+,此时铁的存在形式是________________________________________________________________________(写化学式)。
(5)700 ℃焙烧1的目的是________________;550 ℃焙烧2的目的是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
早期发 现的一种天然准晶颗粒由三种Al、Cu、Fe元素组成
现的一种天然准晶颗粒由三种Al、Cu、Fe元素组成 。回答下列问题:
。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过 方法区分晶体、准晶体和非晶体。
(2)基态铁原子有 个未成对电子,三价铁离子的电子排布式为: 可用硫氰化钾检验三价铁离子,形成配合物的颜色为
(3)新制备的氢氧化铜可将乙醛氧化为乙酸,而自身还原成氧化 亚铜,乙醛中碳原子的杂化轨道类型为 ______;一摩尔乙醛分子中含有的σ键的数目为: 。乙酸的沸点明显高于乙醛,其主要原因是: 。氧化亚铜为半导体材料,在其立方晶胞内部有四个氧原子,其余氧原子位于面心和顶点,则该晶胞中有 个铜原子。
亚铜,乙醛中碳原子的杂化轨道类型为 ______;一摩尔乙醛分子中含有的σ键的数目为: 。乙酸的沸点明显高于乙醛,其主要原因是: 。氧化亚铜为半导体材料,在其立方晶胞内部有四个氧原子,其余氧原子位于面心和顶点,则该晶胞中有 个铜原子。
(4)铝单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为 。列式表示铝单质的密度 g·cm-3(不必计算出结果)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对“摩尔 mol”的叙述不正确的是
A.摩尔是一个单位,用于计量物质所含微观粒子的多少
B.摩尔既能用来计量纯净物,又能用来计量混合物
C.1 mol任何气体所含的气体分子数目都相等
D.用“摩尔”而不用“个”计量微观粒子与用“纳米”而不用“米”计量原子直径,计量思路都是扩大单位
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com