
微型钮扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,负极反应为:Zn+2OH--—2e-==ZnO+H2O;正极反应为:Ag2O+H2O+2e-==2Ag+2OH-,根据反应式,判断下列叙述正确的是
A.在使用过程中,电池正极区溶液的pH增大
B.使用过程中,电子由Ag2O极经外电路流向Zn极
C.Zn是正极,Ag2O是负极
D.Zn电极发生还原反应,Ag2O电极发生氧化反应
科目:高中化学 来源:2014--2015吉林省高一上学期期末化学试卷(解析版) 题型:选择题
已知还原性Cl-< Br-<Fe2+<I-,下列反应不能发生的是
A.2Fe3++2I-=== 2Fe2++ I2 B.Cl2+2Br-=== 2 Cl-+ Br2
C.I2 + 2Cl- === 2I- + Cl2 D.2Fe2++Br2===2Fe3++2Br-
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高二1月月考化学试卷(解析版) 题型:选择题
在下列给定条件的溶液中,一定能大量共存的离子组是
A.无色溶液:Ca2+、H+、Cl-、HSO3-
B.能使pH试纸呈红色的溶液:Na+、NH+4、I-、NO3-
C.NaHCO3溶液:K+、Fe3+、SO42-、NO3-
D.Kw/c(H+)=0.1 mol/L的溶液:Na+、K+、SiO32-、NO3-
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省淄博市高二12月月考化学试卷(解析版) 题型:填空题
(共10分前2个空每空一个1分,其余每空2分)、
依据氧化还原反应2Ag+(aq)+Cu(s) ==== Cu2+(aq)+2Ag(s)设计的原电池如图所示:

请回答下列问题:
(1)外电路中的电子是从_______ 电极流向________电极。
(2)银电极发生的电极反应为________________________;
X电极上发生的电极反应为____________________________;
(3)LiSOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为4Li+2SOCl2===4LiCl +S +SO2↑。请回答下列问题:
写出电池的负极发生的电极反应为____________________________________;
电池正极发生的电极反应为____________________________________
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省淄博市高二12月月考化学试卷(解析版) 题型:选择题
实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏低的是
A.酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3次
B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
C.锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度
D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省淄博市高二12月月考化学试卷(解析版) 题型:选择题
反应FeO(s)+C(s)=Fe(s)+CO(g);△H>0,ΔS>0,下列说法正确的是
A.低温下自发进行,高温下非自发进行 B.高温下自发进行,低温下非自发进行
C.任何温度下均为非自发进行 D.任何温度下均为自发进行
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省平度市高二上学期期中考试化学试卷(解析版) 题型:填空题
(10分)工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO (g) + 2H2 (g)  CH3OH (g) △H=-116kJ/mol
CH3OH (g) △H=-116kJ/mol
(1)该反应的化学平衡常数表达式为 ;
(2)下列措施中有利于增大该反应的反应速率且提高转化率的是 (填字母序号) 。
a.随时将CH3OH与反应混合物分离 b.降低反应温度
c.使用高效催化剂 d.增大体系压强
(3)一定条件下,将1 mol CO与3 mol H2的混合气体在催化剂作用下发生反应生成甲醇,平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是 (填字母序号).
a.c ( H2 )减少
b.正反应速率加快,逆反应速率减慢
c.CH3OH 的物质的量增加
d.重新平衡c ( H2 )/ c (CH3OH )减小
(4)在密闭容器中充有1mol CO与2 mol H2,在催化剂作用下反应生成甲醇,CO的转化率(α)与温度(T)、压强(P)的关系如图所示。

①A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间,tA tC(填于“大于”、“小于”或“等于”)。
②若A点时容器的体积为1 L,该温度下B点的平衡常数K= 。
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省平度市高二上学期期中考试化学试卷(解析版) 题型:选择题
在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g), 2 min后该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。则下列判断正确的是
xC(g)+2D(g), 2 min后该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。则下列判断正确的是
A.x=2
B.2 min内A的反应速率为0.6 mol·L-1·min-1
C.B的转化率为40%
D.若混合气体的密度不变,则表明该反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省赣州市北校区高二1月月考化学试卷(解析版) 题型:选择题
对反应A+B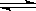 AB来说,常温下按以下情况进行反应:
AB来说,常温下按以下情况进行反应:
①20 mL溶液中含A、B各0.01 mol ②50 mL溶液中含A、B各0.05 mol
③0.1 mol·L-1的A、B溶液各10 mL ④0.5 mol·L-1的A、B溶液各50 mL
四者反应速率的大小关系是
A.②>①>④>③ B.④>③>②>① C.①>②>④>③ D.①>②>③>④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com