
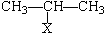 Ⅰ
Ⅰ CH=CH2)与丙烯的共聚物是一种高分子阻燃剂,具有低毒、热稳定性好等优点.
CH=CH2)与丙烯的共聚物是一种高分子阻燃剂,具有低毒、热稳定性好等优点. 或
或
 CHBrCH3.
CHBrCH3. CHBrCH3与足量氢氧化钠溶液共热得到A,得到A时,苯环上没有化学键的断裂和生成.
CHBrCH3与足量氢氧化钠溶液共热得到A,得到A时,苯环上没有化学键的断裂和生成.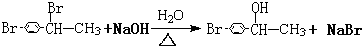 .
.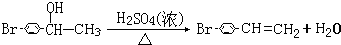 .
.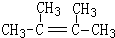 ,1molB完全燃烧时耗氧9mol
,1molB完全燃烧时耗氧9mol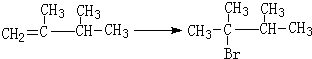
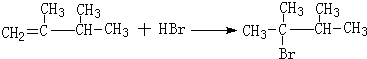
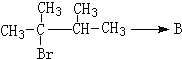
 .
. 分析 (1)对溴乙苯和丙烯能发生加聚反应,连接对溴乙苯中亚甲基的可能是丙烯中中间碳原子也可能是连接碳碳双键的边上的碳原子;
(2)乙苯和溴发生取代反应时需要溴化铁作催化剂;苯环上H原子被溴取代时需要光照条件;
(3)得到A时没有苯环上化学键断裂和生成,说明连接亚甲基的溴原子发生取代反应;
由此可见苯环上的卤素原子比侧链的卤素原子难发生取代反应;根据反应物、生成物和反应条件书写方程式;
(4)丙烯催化二聚得到2,3-二甲基-1-丁烯,B与2,3-二甲基-1-丁烯互为同分异构体,且所有碳原子处于同一平面,则B结构简式为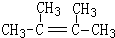 ,B的分子式为C6H12,1mol该物质耗氧量=(6+$\frac{12}{4}$)mol;
,B的分子式为C6H12,1mol该物质耗氧量=(6+$\frac{12}{4}$)mol;
①该反应为2,3-二甲基和HBr的加成反应;
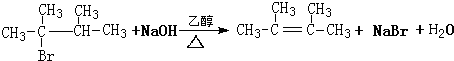
②该反应为消去反应,需要NaOH的醇溶液和加热条件.
解答 解:(1)对溴乙苯和丙烯能发生加聚反应,连接对溴乙苯中亚甲基的可能是丙烯中中间碳原子也可能是连接碳碳双键的边上的碳原子,所以所得结构简式为 或
或 ,故答案为:
,故答案为: 或
或 ;
;
(2)乙苯和溴发生取代反应时需要溴化铁作催化剂,所以需要液溴和Fe作催化剂;苯环上H原子被溴取代时需要光照条件,所以需要溴蒸气和光照,
故答案为:液溴和Fe作催化剂;溴蒸气和光照;
(3)得到A时没有苯环上化学键断裂和生成,说明连接亚甲基的溴原子发生取代反应,反应方程式为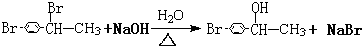 ;
;
由此可见苯环上的卤素原子比侧链的卤素原子难发生取代反应;根据反应物、生成物和反应条件书写方程式为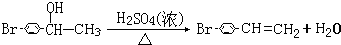 ,
,
故答案为: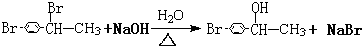 ;苯环上的卤素原子比侧链的卤素原子难发生取代反应;
;苯环上的卤素原子比侧链的卤素原子难发生取代反应;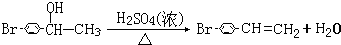 ;
;
(4)丙烯催化二聚得到2,3-二甲基-1-丁烯,B与2,3-二甲基-1-丁烯互为同分异构体,且所有碳原子处于同一平面,则B结构简式为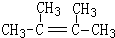 ,B的分子式为C6H12,1mol该物质耗氧量=(6+$\frac{12}{4}$)mol=9mol,
,B的分子式为C6H12,1mol该物质耗氧量=(6+$\frac{12}{4}$)mol=9mol,
故答案为: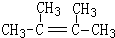 ;9;
;9;
①该反应为2,3-二甲基和HBr的加成反应,反应方程式为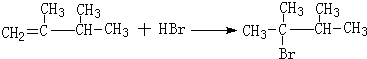 ,故答案为:
,故答案为: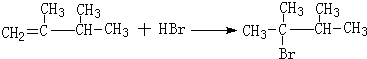 ;
;
②该反应为消去反应,需要NaOH的醇溶液和加热条件,反应方程式为 ,故答案为:
,故答案为: .
.
点评 本题考查有机物推断及有机物结构和性质,为高频考点,明确官能团及其性质关系,注意结合题给信息进行分析解答,侧重考查学生分析及知识运用能力,熟悉常见有机物性质及有机反应类型,题目难度不大.


科目:高中化学 来源: 题型:解答题
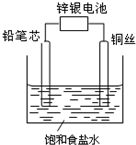 锌银电池能量大、电压平稳,广泛用于电子手表、照相机、计算器和其他微型电子仪器.锌银电池电解质溶液是KOH溶液,电池总反应为Zn+Ag2O═ZnO+2Ag.请回答下列问题:
锌银电池能量大、电压平稳,广泛用于电子手表、照相机、计算器和其他微型电子仪器.锌银电池电解质溶液是KOH溶液,电池总反应为Zn+Ag2O═ZnO+2Ag.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验组 | 温度℃ | 起始量mol | 平衡量mol | 达平衡所需时间min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度/(g/100g水) |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤 | |
| B. | 转移溶液前容量瓶内有少量蒸馏水 | |
| C. | 定容时,俯视容量瓶的刻度线 | |
| D. | 定容摇匀时,发现液面降低,又补加少量水,重新达到刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )是一种可降解的聚酯类高分子材料,在材料的生物相容性方面有很好的应用前景.PPG的一种合成路线如下:
)是一种可降解的聚酯类高分子材料,在材料的生物相容性方面有很好的应用前景.PPG的一种合成路线如下: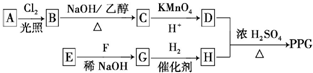
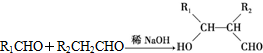

 .
. .
. .
.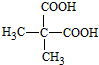
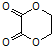 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2Br$→_{加热}^{NaOH/醇}$CH2=CH2$→_{催化剂}^{H_{2}O}$CH3CH2OH.
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2Br$→_{加热}^{NaOH/醇}$CH2=CH2$→_{催化剂}^{H_{2}O}$CH3CH2OH.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com