
科目:高中化学 来源:不详 题型:单选题
| A.纯净的重水(D2O)中,pD=7 |
| B.1 L溶解有0.01 mol DCl的重水溶液,其pD=12.0 |
| C.纯净的重水中,c(D+)=c(OD-) |
| D.1 L溶解有0.01 mol NaOD的重水溶液,其pD=12.0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
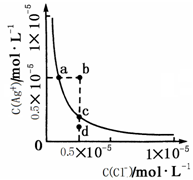
| A.加入NaCl可以使溶液由a点变到b点 |
| B.向AgCl饱和溶液中加入水, C(Ag+)增大 |
| C.d点无AgCl沉淀生成 |
| D.a点对应的Ksp大于c点对应的Ksp |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
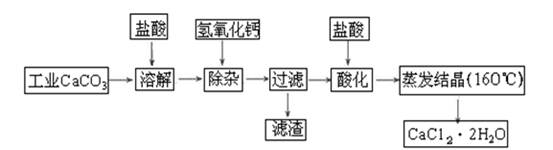 (1)除杂操作是加入氢氧化钙固体,调节溶液的pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+,检验Fe(OH)3是否沉淀完全的实验操作是_____________________________________
(1)除杂操作是加入氢氧化钙固体,调节溶液的pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+,检验Fe(OH)3是否沉淀完全的实验操作是_____________________________________
 ______________,
______________, 11mol3·L-3,求该温度下饱和的Mg(OH)2溶液的pH为 。
11mol3·L-3,求该温度下饱和的Mg(OH)2溶液的pH为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.pH=7的溶液一定是中性溶液 |
| B.能自发进行的化学反应,不一定是△H<0、△S>0 |
| C.白色污染、绿色食品中的“白”“绿”均指相关物质的颜色 |
| D.Ksp不仅与难溶电解质的性质和温度有关,而且与溶液中的离子浓度有关 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A. 6; 6×10-7 mol·L-1 | B. 7; 1×10-5 mol·L-1 |
| C.7 ; 4×10-8 mol·L-1 | D. 6; 1× 10-5 mol·L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | KW | 1×10-12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com