
【题目】在恒容绝热条件下,一定能说明反应A(g)+B(?)![]() 2C(g)已达到平衡状态的是
2C(g)已达到平衡状态的是
A. 容器内的密度不再变化 B. C的生成速率与A的分解速率之比为2:1
C. 混合物的平均摩尔质量不再变化 D. 容器内的温度不再发生变化
【答案】D
【解析】试题分析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。A.密度是混合气的质量和容器容积的比值,但由于不能确定B的状态,因此容器内的密度不再变化不一定达到平衡状态,A错误;B.C的生成速率与A的分解速率均表示正方应速率,因此不能说明反应达到平衡状态,B错误;C.混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,但由于不能确定B的状态,因此混合物的平均摩尔质量不再变化不一定达到平衡状态,C错误;D.由于是恒容绝热容器,因此容器内的温度不再发生变化可以说明反应达到平衡状态,D正确,答案选D。


科目:高中化学 来源: 题型:
【题目】有硫酸镁溶液500mL,它的密度是1.20g·cm3,其中镁离子的质量分数是4.8%,则有关该溶液的说法不正确的是
A. 溶质的质量分数是24% B. 溶液的物质的量浓度是2.4mol·L1
C. 溶质和溶剂的物质的量之比约为1∶21.1 D. 硫酸根离子的质量是230.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镓与ⅤA族元素形成的化合物是重要的半导体材料,应用最广泛的是砷化镓(GaAs)。回答下列问题:
(1)基态Ga原子的核外电子排布式为__________,基态As原子核外有__________个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为__________和+3。砷的电负性比镓__________(填“大”或“小”)。
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:__________________________。
镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |
GaF3的熔点超过1000℃,可能的原因是_______________________________________。
(4)二水合草酸镓的结构如图所示,其中镓原子的配位数为__________,草酸根中碳原子的杂化方式为__________。

(5)砷化镓熔点为1238℃,立方晶胞结构如图所示,晶胞参数为a=565pm,该晶体的类型为__________,晶体的密度为__________(设NA为阿伏加德罗常数的数值,列出算式即可)g·cm-3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2 L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。

(1)起始时X的浓度为c(X)=________;反应从开始至2分钟末,Y的转化率为α(Y)=________;用Z的浓度变化表示0~2分钟内的平均反应速率为v(Z)=________。
(2)由图中所给数据进行分析,该反应的化学方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌﹣锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)![]() Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
A. 电池工作时,锌失去电子
B. 电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e﹣=Mn2O3(s)+2OH﹣(aq)
C. 电池工作时,电子由正极通过外电路流向负极
D. 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=5.0×10-13。该温度下,下列说法错误的是
A. AgCl的悬浊液中通入少量HCl,c(Ag+)减小
B. AgCl和AgBr共存的悬浊液中,c(Cl-)/c(Br-)=360
C. AgBr悬浊液中加入足量NaCl可能有AgCl沉淀生成
D. 等浓度的NaCl和NaBr混合溶液中滴加AgNO3溶液,先析出AgCl沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中,吸收的热量用于克服分子间作用力的是( )
A. 加热氯化钠使之熔化 B. 加热二氧化硅使之熔化
C. 液溴受热变成溴蒸气 D. 加热碘化氢使之分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中通常伴随着能量变化,下列说法中错误的是( )
A. 煤燃烧时将部分化学能转化为热能
B. 电解水制氢气时将部分化学能转化为电能
C. 炸药爆炸时将部分化学能转化为动能
D. 镁条燃烧时将部分化学能转化为光能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
K、Fe、Ni均为重要的合金材料,在工业生产、科技、国防领域有着广泛的用途,请回答下列问题:
(1)K元素处于元素周期表的_____ 区,其基态原子中,核外电子占据的电子云轮廓图为球形的能级有______个。
(2)KCl 和NaCl 均为重要的化学试剂,KCl 的熔点低于NaCl的原因为___________。
(3)从原子结构角度分析,Fe3+比Fe2+更稳定的原因是__________。
(4)NiSO4 溶于氨水形成[Ni (NH3)6]SO4。
①写出一种与[Ni(NH3)6]SO4中的阴离子互为等电子体的分子的分子式_________。
②1mol[Ni(NH3)6]SO4中含有σ键的数目为___________。
③NH3 的VSEPR模型为_____ ;中心原子的杂化形式为_____,其杂化轨道的作用为__________。
(5)K、Ni、F三种元素组成的一种晶体的长方体晶胞结构如图所示。若NA为阿伏加德罗常数的值,该晶体的密度ρ=______g/cm3(用代数式表示)。
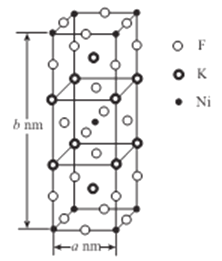
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com