

| 滴定次数 | 待测液体的体积/mL | 标准碱溶液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 第一次 | 20.00mL | 0.00 | 20.98 |
| 第二次 | 20.00mL | 0.22 | 20.20 |
| 第三次 | 20.00mL | 0.36 | 20.38 |
分析 (1)装置③中FeS2与氧气反应,生成氧化铁和二氧化硫;
(2)萃取、分液的主要仪器为分液漏斗,根据滴定生成的酸在水溶液中,所以需要取上层水溶液;
(3)装置①装有酸性高锰酸钾溶液,具有强氧化性,可氧化除去空气中的还原性气体,提高实验的准确率;
(4)根据题意,用氢氧化钠滴定混合强酸溶液,所以常用的指示剂为酚酞,滴定达到终点时,溶液由无色变为浅红色;
(5)对于多次测量数据一般要求平均值进行数据处理,由于第一次所消耗标准液的体积与后两次相关较大,为减小误差,只求后两次标准液的体积的平均值:20.00ml,根据反应4FeS2+11O2=2Fe2O3+8SO2,I2+SO2+2H2O=2HI+H2SO4,H++OH-═H2O,得关系式S~SO2~4H+~4OH-,所以样品中硫元素的质量为:$\frac{0.020×0.20}{4}$mol×32g/mol×$\frac{300ml}{20ml}$=0.48g,据此计算样品中硫元素的质量分数;
(6)装置⑤所得溶液为HI、H2SO4的混合溶液,为测得硫的质量分数,最好选用能与SO42-反应生成不溶于酸性溶液的沉淀.
解答 解:(1)装置③中FeS2与氧气反应,生成氧化铁和二氧化硫,反应的化学方程式是4FeS2+11O2 $\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+8SO2,
故答案为:4FeS2+11O2 $\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+8SO2;
(2)萃取、分液的主要仪器为分液漏斗,因为CCl4密度大于水,所以萃取碘后,有机层在下层,水溶液为上层,则后续滴定生成的酸在水溶液中,所以需要取上层水溶液,
故答案为:分液漏斗;上;
(3)装置①装有酸性高锰酸钾溶液,具有强氧化性,可氧化除去空气中的还原性气体,提高实验的准确率,
故答案为:除去空气中的还原性气体,提高实验的准确率;
(4)根据题意,用氢氧化钠滴定混合强酸溶液,所以常用的指示剂为酚酞,滴定达到终点时滴入最后一滴NaOH溶液后,溶液变为浅红色,并在半分钟内不褪色,
故答案为:酚酞;滴入最后一滴NaOH溶液后,溶液变为浅红色,并在半分钟内不褪色;
(5)对于多次测量数据一般要求平均值进行数据处理,由于第一次所消耗标准液的体积与后两次相关较大,为减小误差,只求后两次标准液的体积的平均值:20.00ml,根据反应4FeS2+11O2=2Fe2O3+8SO2,I2+SO2+2H2O=2HI+H2SO4,H++OH-═H2O,得关系式S~SO2~4H+~4OH-,所以样品中硫元素的质量为:$\frac{0.020×0.20}{4}$mol×32g/mol×$\frac{200mL}{20mL}$=0.32g,所以样品中硫元素的质量分数为$\frac{0.32}{2.0}$×100%=16.0%,
故答案为:16.0%;
(6)装置⑤所得溶液为HI、H2SO4的混合溶液,为测得硫的质量分数,最好选用能与SO42-反应生成不溶于酸性溶液的沉淀,即氯化钡符合题意,故选:D.
点评 本题考查了利用二氧化硫的性质测定黄铁矿中硫的质量分数,涉及热化学方程式的书写、滴定实验指示剂的选择以及计算等,考查知识点较多,难度中等.


 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:选择题
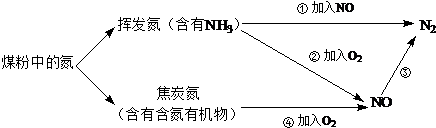
| A. | ②⑤④③①⑥ | B. | ④①②⑤③⑥ | C. | ④②①③⑤⑥ | D. | ⑤②④①③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
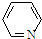 ),其分子中相邻的C和N原子相比,N原子吸引电子能力更强(填“强”或“弱”),从原子结构角度解释原因:C和N在周期表的位置是同一周期从左到右,N 的原子半径更小,原子核对外层电子的吸引力更强.
),其分子中相邻的C和N原子相比,N原子吸引电子能力更强(填“强”或“弱”),从原子结构角度解释原因:C和N在周期表的位置是同一周期从左到右,N 的原子半径更小,原子核对外层电子的吸引力更强.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤操作中,用玻璃棒引流 | |
| B. | 给试管里的液体加热,液体的体积一般不超过试管容积的$\frac{1}{3}$ | |
| C. | 酒精灯中的酒精不能少于$\frac{1}{3}$,不多于$\frac{2}{3}$ | |
| D. | 稀释浓H2SO4时,必须是浓H2SO4慢慢加入水中,并不断用玻璃棒搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 血红素中含有C、H、O、N、Fe五种元素.回答下列问题:
血红素中含有C、H、O、N、Fe五种元素.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液保存在带玻璃塞试剂瓶中 | B. | 氯水保存棕色细口瓶中 | ||
| C. | 钠保存在煤油中 | D. | 液氯可以保存在干燥的钢瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ZW Y X | B. | XYW Z | C. | YWZX | D. | ZWXY |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com