
分析 (1)具有相同核电荷数即质子数的同一类原子的总称叫元素;具有相同质子数,不同的中子数的核素互称同位素;
(2)在阴离子中,质子数=核外电子数-所带电荷数,质量数=质子数+中子数,据此分析;
(3)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热;
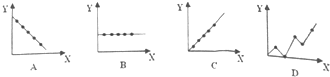
(4)①根据同一主族元素的最外层电子数相等;
②第三周期的最高化合价从左→右依次升高;
③碱金属单质的熔点逐渐降低.
解答 解:(1)原子:126C、147N、2311Na、31H、23592U、4019K、23892U,质子数相同属于同一元素,所以共有6种元素;23592U、23892U质子数都92,中子数不同,属于同位素;
故答案为:6、23592U、23892U;
(2)AXa-质子数=核外电子数-所带电荷数=x-a,又根据质量数=质子数+中子数,即中子数=质量数-质子数=A-(x-a);
故答案为:A-x+a;
(3)在反应N2+3H2?2NH3中,断裂3molH-H键,1molN三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2molNH3,共形成6molN-H键,放出的能量为:6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,生成2molNH3放出的热量为:2346kJ-2254kJ=92kJ,所以生成1molNH3放出的热量为46KJ.
故答案为:放出;46;
(4)①ⅡA族元素的最外层电子数相等,图象B符合;
故答案为:B;
②第3周期的最高化合价从左→右依次升高,图象C符合;
故答案为:C;
③碱金属单质的熔点逐渐降低,图象A符合;
故答案为:A.
点评 本题主要考查同位素、原子构成、元素周期律、反应热计算,属于拼合型题目,注意对基础知识的理解掌握.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | π键数:乙烷>乙烯>乙炔 | B. | α键数:乙烷>乙烯>乙炔 | ||
| C. | 碳原子的杂化方式:sp、sp2、sp3 | D. | 碳碳键的键能:乙烷>乙烯>乙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | A2+与D2-的核外电子数相等 | |
| B. | 氢化物的稳定性为H2E<H2D | |
| C. | B与E形成的化合物既能溶于盐酸又可溶于氢氧化钠溶液 | |
| D. | 最高价氧化物对应水化物碱性:B比A的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积分数75%的乙醇溶液常用于医疗消毒 | |
| B. | 乙醇、乙烷和乙酸都可以与钠反应生成氢气 | |
| C. | 苯和乙烯都可以使溴的四氯化碳溶液褪色 | |
| D. | 石油分馏可获得各种烷烃、苯及其他衍生物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1,△H2都不变 | B. | △H1,△H2都增大 | C. | △H1,△H2都减小 | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇与金属钠反应时,是乙醇分子中羟基中的O-H键断裂 | |
| B. | 检验乙醇中是否含有水,可加入少量无水硫酸铜,若变蓝则含水 | |
| C. | 禁止用工业酒精配制饮用酒和调味用的料酒 | |
| D. | 溴乙烷、TNT、丙三醇都是无色溶于水的有机化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com