
| A. | 两极附近颜色无明显变化 | B. | 两极产生等量气体 | ||
| C. | 阳极附近的颜色变红 | D. | 阴极附近的颜色变红 |
分析 紫色石蕊试液遇酸变红色、遇碱变蓝色、遇中性溶液为紫色,电解硫酸钠和石蕊的混合液,阴极上水得电子生成氢气和OH-,阴极附近溶液呈碱性;阳极上水失电子生成氧气和H+,所以阳极附近溶液呈酸性,据此判断.
解答 解:紫色石蕊试液遇酸变红色、遇碱变蓝色、遇中性溶液为紫色,电解硫酸钠和石蕊的混合液,阴极上水得电子生成氢气和OH-,阴极附近溶液呈碱性,则阴极附近的颜色变蓝色;阳极上水失电子生成氧气和H+,所以阳极附近溶液呈酸性,则阳极附近的颜色变红,阴极产生的氢气是阳极产生的氧气2倍,故选C.
点评 本题考查电解原理,为高频考查,侧重考查学生分析判断能力,明确各个电极上发生的反应及酸碱指示剂特点是解本题关键,熟练掌握常见离子放电顺序,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
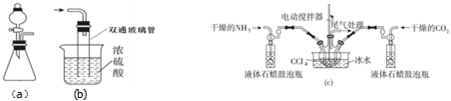
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
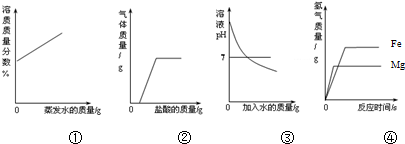
| A. | ①在恒温的条件下,将足量的氯化钠饱和溶液蒸发适量的水分 | |
| B. | ②向露置在空气中部分变质的氢氧化钠溶液中加入稀盐酸 | |
| C. | ③向氢氧化钠溶液中不断加水稀释 | |
| D. | ④相同质量的且过量的镁粉和铁粉,分别与质量和质量分数相同的稀盐酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤操作中,漏斗的尖端应接触烧杯内壁 | |
| B. | 用玻璃棒蘸取CH3COOH溶液点在水湿润的pH试纸上,测定该溶液的pH | |
| C. | 中和滴定时.滴定管用所盛装的反应液润洗2~3 次. | |
| D. | 分液操作中,下层液体从下端放出,上层液体从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
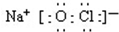 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验事实 | 结论 | |
| A | Cl2的水溶液能导电 | Cl2是电解质 |
| B | SO2通入硝酸钡溶液出现白色沉淀 | BaSO3不溶于强酸 |
| C | 金属钠与乙醇反应不如钠与水反应剧烈 | 乙醇分子中的羟基氢原子不如水分子中的氢原子活泼 |
| D | 加热煮沸滴有石蕊试液的SO2水溶液,红色褪去 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
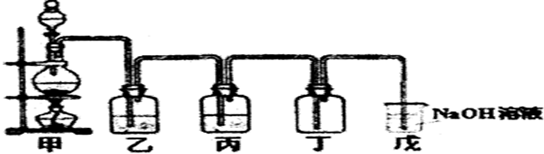
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com