
【题目】镁、硅及其化合物用途非常广泛。回答下列问题:
(1)基态Si原子价层电子的电子排布式为___,基态Mg原子电子占据最高能级的能层符号___。
(2)Mg2C3与CaC2的结构相似,与水反应可生成H2C=C=CH2,H2C=C=CH2端位碳原子的杂化方式是__,该反应所涉及的元素中电负性最小的是__(填元素符号),Mg2C3和H2C=C=CH2中均不存在___(填字母)。
A.σ键 B.配位键 C.氢键 D.π键
(3)晶格能又叫点阵能。它是1mol离子化合物中的正、负离子从相互分离的气态结合成离子晶体时所放出的能量。MgO晶格能可通过图1的BornHaber循环计算得到。
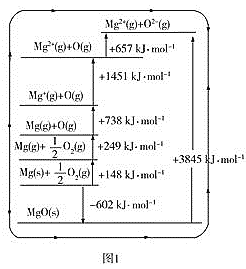
MgO的晶格能为___kJ·mol-1,O=O键的键能为__kJ·mol-1;Mg的第一电离能为___kJ·mol-1;
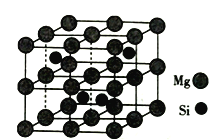
(4)Mg2Si晶胞结构如图2所示,已知其密度为1.84g·cm3,NA为阿伏加德罗常数的值。则晶胞参数a=__nm(列出计算式即可)。
【答案】3s23p2 M sp2 Mg BC 3845 498 738 
【解析】
(1)Si的原子序数是14,Mg的原子序数是12,根据核外电子排布式确定它们的价电子排布式;
(2)H2C=C=CH2端位碳原子,形成3个![]() 键,没有孤电子对;同一周期,从左到右,电负性依次增强,同一主族,从上到下电负性依次减弱;
键,没有孤电子对;同一周期,从左到右,电负性依次增强,同一主族,从上到下电负性依次减弱;
(3)Mg的第一电离能为气态Mg原子失去第一个电子时需要吸收的能量;由1molO2分子变成O原子的过程中,需要吸收的能量为(249×2)kJ;晶格能是气态离子形成1mol离子晶体释放的能量;
(6)Mg2Si晶胞结构如图2所示,利用均摊法找出晶胞中有8个Mg,有4个Si,然后进行相关计算,求出晶胞参数a。
(1)Si的原子序数是14,价电子排布式为3s23p2;Mg的原子序数是12,位于第三周期,故最高能层符号为M;
(2)H2C=C=CH2端位碳原子,形成3个![]() 键,没有孤电子对,故杂化类型为sp2,所涉及的元素中,电负性最小的是Mg;
键,没有孤电子对,故杂化类型为sp2,所涉及的元素中,电负性最小的是Mg;
A.Mg2C3中的C32-离子和H2C=C=CH2中均存在σ键,A不符合题意;
B.Mg2C3和H2C=C=CH2中均不存在配位键,B符合题意;
C.Mg2C3和H2C=C=CH2中均不存在氢键,C符合题意;
D.Mg2C3中的C32-离子和H2C=C=CH2中均存在π键,D不符合题意;
答案选BC;
(3)结合图像,晶格能是气态离子形成1mol离子晶体释放的能量,MgO的晶格能为3845kJ·mol-1;由1molO2分子变成O原子的过程中,需要吸收的能量为(249×2)kJ=498kJ;Mg的第一电离能为气态Mg原子失去第一个电子时需要吸收的能量为738 kJ·mol-1;
(4)Mg2Si晶胞结构如图2所示,Mg在顶点、面心、棱上和体心,利用均摊法计算出晶胞中含有的Mg为:![]() =8,Si在晶胞内部,有4个,(a×10-7 )3×1.84×NA=24×8+28×4,a=
=8,Si在晶胞内部,有4个,(a×10-7 )3×1.84×NA=24×8+28×4,a= nm。
nm。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】我国科学家受中医启发,发现As2O3(俗称砒霜)对白血病有疗效。氮、磷、砷(As)是VA族、第二至第四周期的元素,这些元素的化合物在研究和生产中有许多重要用途。
完成下列填空:
(1)As原子最外层电子的轨道表示式为_____________;砷蒸气的分子式:As4,其分子结构与白磷(P4)相似,也是正四面体,则As4中砷砷键的键角是__________。
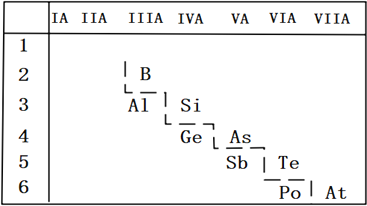
(2)P的非金属性比As强,从原子结构的角度解释其原因_______;如图是元素周期表的一部分,请推测砷的单质或其化合物可能具有的性质_______________(写出两条即可)
(3)NH4NO3可做化肥,但易爆,300℃发生爆炸:2NH4NO3→2N2↑+O2↑+4H2O。每生成2molN2,反应中转移的电子为_____mol,氧化产物与还原产物的质量之比为_____。
(4)发电厂常用氨气吸收烟气中的CO2。常温下,当CO2不断通入pH=11的氨水中时会产生微量的新离子:NH2COO-。
(i)写出NH2COO-的电子式___________。
(ii)计算原氨水中c(NH4+)=_______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO、NO2可被氨水溶液吸收(6NO+ 4NH3→5N2+6H2O;6NO2+ 8NH3→7N2+12H2O)。现有NO与NO2(不含N2O4)混合气体90mol被30%的氨水4.45×103g完全吸收,产生78mol氮气。吸收后氨水密度为0.980 g/cm3。则
A.原混合气体的平均组成为NO1.1B.原氨水的浓度约为17.3mol/L
C.吸收后氨水的浓度约为2.4mol/LD.吸收后氨水的质量分数约为0.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用小粒径零价铁(ZVI)的电化学腐蚀处理三氯乙烯,进行水体修复的过程如图所示。H+,O2,NO3-等共存物的存在会影响水体修复效果,定义单位时间内ZVI释放电子的物质的量为nt,其中用于有效腐蚀的电子的物质的量为ne。下列说法错误的是( )
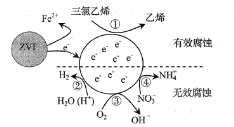
A. 反应①②③④均在正极发生
B. 单位时间内,三氯乙烯脱去amolCl时ne=amol
C. ④的电极反应式为NO3-+10H++8e-=NH4++3H2O
D. 增大单位体积水体中小粒径ZVI的投入量,可使nt增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.02mol/LMOH溶液逐滴滴入100mL0.01mol/LHA溶液中,溶液pH随滴入MOH溶液的体积变化如图所示。若忽略溶液混合时的体积变化,下列叙述正确的是( )
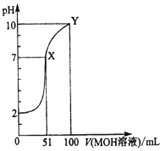
A.温度不变,滴入MOH溶液的过程中水的电离程度不变
B.X点MOH过量,故溶液中c(M+)>c(A-)
C.HA为弱酸,MOH为强碱
D.Y点的c(MOH)+c(M+)=0.01mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增加。甲、丙、戊是由这些元素组成的二元化合物。乙是元素W的单质,通常为黄绿色气体,丁的水溶液具有漂白性,0.01mol/L戊溶液的pH为2,己通常是难溶于水的混合物。上述物质的转化关系如图所示。回答下列问题:

(1)写出化合物丁的结构式__。
(2)X、Z元素可形成原子个数比为1∶1的化合物,它的电子式为___。
(3)X、Y元素组成的某化合物分子中含18个电子。10g该化合物在空气充分燃烧生成稳定的氧化物放出的热量为QkJ,写出表示该物质燃烧热的热化学方程式___。
(4)Z、W两种元素组成的化合物WZ2的用途有___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),
如图所示。导致该现象的主要原因是液滴下面的氧气
含量比液滴边缘少。下列说法正确的是

A.(a)区腐蚀比(b)区腐蚀严重
B.该过程发生了化学反应:4Fe+3O2=2Fe2O3
C.该过程是析氢腐蚀,负极反应为:Fe-2e- =Fe2+
D.该过程为吸氧腐蚀,正极反应为:O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组为研究碳酸钠水解平衡与温度的关系,用数字试验系统测定一定浓度碳酸钠溶液的pH与温度的关系,得到曲线如图,下列分析不合理的是( )

A.碳酸钠水解是吸热反应
B.ab段说明水解平衡向右移动
C.bc段说明水解平衡向左移动
D.水的电离平衡也对pH产生影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,容积一定的密闭容器中发生反应A(s)+2B(g)![]() C(g)+D(g),当下列物理量不再发生变化时,表明反应已达平衡的是
C(g)+D(g),当下列物理量不再发生变化时,表明反应已达平衡的是
①混合气体的密度 ②混合气体的压强 ③B的物质的量浓度 ④混合气体的总物质的量
A. ①② B. ②③ C. ①③ D. ①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com