
(Ⅰ)某二元酸(H2A)在水中的电离方程式是:H2A===H++HA-,HA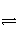
 -H++A2-。
-H++A2-。
(1)Na2A溶液显________(填“酸性”、“中性”或“碱性”)。理由是
________________________________________________________________________
(用离子方程式表示)。
(2)已知0.1 mol/L NaHA溶液的pH=2,则0.1 mol/L H2A溶液中氢离子的物质的量浓度应______0.11 mol/L(填“<”、“>”或“=”),理由是
________________________________________________________________________
________________________________________________________________________。
(Ⅱ)25℃时,A酸溶液的pH=a,B碱溶液的pH=b。
(1)若A为强酸,B为强碱,且a+b=14,若两者等体积混合后,溶液的pH=________,此时溶液中金属阳离子浓度大于酸根阴离子浓度,其原因可能是
________________________________________________________________________。
(2)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显酸性,则混合溶液中必定有一种离子能发生水解,该离子为__________(填离子符号);混合后的溶液中,下列微粒浓度大小关系一定正确的是____________(填序号)。
①c(MOH)>c(M+)>c(R-)>c(H+)>c(OH-)
②c(HR)>c(M+)>c(R-)>c(OH-)>c(H+)
③c(R-)>c(M+)>c(H+)>c(OH-)
④c(M+)>c(R-)>c(OH-)>c(H+)
⑤c(M+)+c(H+)=c(R-)+c(OH-)
答案 (Ⅰ)(1)碱性 A2++H2O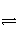
 HA-+OH-
HA-+OH-
(2)< H2A完全电离出的0.1 mol/L H+对其第二步电离平衡产生抑制
(Ⅱ)(1)7 酸为二元强酸,碱为一元强碱
(2)R- ③⑤
解析 本题主要考查弱电解质的电离平衡、盐类的水解、pH的计算、溶液中微粒浓度大小的比较等。
(Ⅰ)注意H2A第一级电离完全电离,而第二级电离是可逆的,因此Na2A溶液水解显碱性;H2A第一级电离产生的氢离子对第二级电离产生抑制作用,所以0.1 mol/L H2A溶液中氢离子的物质的量浓度小于0.11 mol/L。
(Ⅱ)(1)抓住强酸强碱中的氢离子和氢氧根离子物质的量相等来计算。
(2)中混合后溶液呈酸性说明酸为弱酸,弱酸的阴离子R-发生水解,混合溶液中以酸的电离为主,因此酸根离子最多,其次是盐电离出的阳离子,再根据电荷守恒判断等式是否成立。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
某有机物的结构简式为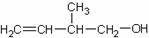 ,下列关于该有机物的叙述不正确的是
,下列关于该有机物的叙述不正确的是
A.能与金属钠发生反应并放出氢气
B.能在催化剂作用下与氢气发生加成反应
C.在铜的催化作用下,能被氧化成羧酸类物质
D.在浓硫酸催化下,能与乙酸发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
现有六种有机物:①乙醇、②苯酚、③溴乙烷、④乙烯、⑤乙酸、⑥甲酸乙酯,其中(填写序号):
(1)一定条件下能发生银镜反应的是________。
(2)一定条件下能发生消去反应的是________。
(3)一定条件下能与H2发生加成反应的是________。
(4)一定条件下能与NaOH溶液发生反应的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
有关下 图所示化合物的说法不正确的是( )
图所示化合物的说法不正确的是( )
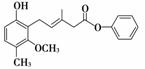
A.该化合物既可以催化加氢,又可以在光照下与Cl2发生取代反应
B.该化合物既可以与溴水反应,又可以使酸性KMnO4溶液褪色
C.该化合物既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
D.1 mol该化合物最多可以与2 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.Ksp只与难溶电解质的性质和温度有关
B.由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀
C.其他条件不变,离子浓度改变时,Ksp不变
D.两种难溶电解质作比较时,Ksp小的,溶解度一定小
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.CH3COOH与CH3COONa混合溶液中,一定有c(CH3COO-) >c(Na+)
B.向新制氯水中加入CaCO3可使溶液中HClO浓度增大
C.AgCl在200ml 0.1mol/LNaCl中的溶解度小于在50ml 0.1mol/LMgCl2中溶解度
D.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
查看答案和解析>>
科目:高中化学 来源: 题型:
I.在体积为2L的密闭容器中,加入1mol A与4mol B发生反应:
A(g)+ 2B(g) 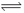 2 C(g) △H= QkJ/mol。达平衡时A的转化率α与温度的变化如下表。
2 C(g) △H= QkJ/mol。达平衡时A的转化率α与温度的变化如下表。
| 温度℃ | 200 | 300 | 500 |
| α | 0.5 | 0.4 | 0.3 |
(1)Q 0(填< 、>、=)。
(2)在200℃时,若经5min达到平衡,则用物质C表示的平均速率为 。
(3)200℃时,将容器体积压缩为1L,平衡时的平衡常数K= 。
II.已知:
由常见的有机物A[CH2=C(CH3)2]可以实现如下的转化:
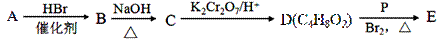
(1)A的系统命名为 ;B→C的反应类型是 。
(2)C的一种同类别的同分异构体M,M能发生催化氧化反应生成醛,则M 的结构简式为 。
(3)写出E与足量的氢氧化钠溶液共热反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照明器材等领域亦有广泛应用。回答下列问题。
(1)久存的银制器皿表面会变黑,失去银白色的光泽,原因是 。
(2)已知Ksp(AgCl)=1.8×10-10,若向50mL0.018mol·L-1的AgNO3溶液中加入50mL0.020mol·L-1的盐酸,混合后溶液中的Ag+的浓度为 mol·L-1,pH为 。
(3)AgNO3溶液光照易分解,生成Ag和红棕色气体等物质,其光照分解的化学方程式为 。
(4)右图所示原电池正极的反应式为 。

查看答案和解析>>
科目:高中化学 来源: 题型:
有无色溶液,加入Na2O2时有无色无味气体放出,并有白色沉淀生成,加入Na2O2的量与生成白色沉淀的量如图所示.该无色溶液中含有的物质是()
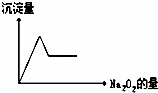
| A. | CaCl2和MgCl2、 | B. | Al2 (SO4)3 | |
| C. | Al2(SO4)3和MgSO4 | D. | Na2SO4和MgSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com