
ЁОЬтФПЁПФГаЃЛЏбЇаЫШЄаЁзщЮЊбаОПТШЦјЕФаджЪВЂФЃФтЙЄвЕжЦБИЦЏАзЗлЃЌЩшМЦСЫЯТСазАжУНјааЪЕбщЁЃвбжЊЃК
ЂйA жаЗДгІЮЊ KClO3ЃЋ6HCl(ХЈ) = KClЃЋ3Cl2ЁќЃЋ3H2OЃЛ
ЂкЪЏЛвШщЕФжївЊГЩЗжЮЊ Ca(OH)2ЃЌЦфЫћдгжЪВЛВЮгыЗДгІЁЃ
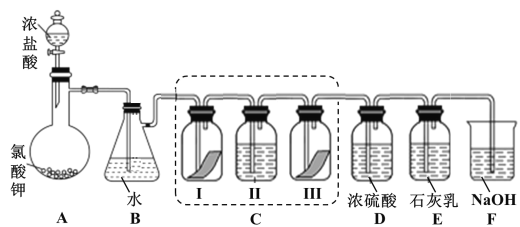
ЃЈ1ЃЉаДГі B зАжУжаЗДгІЕФЛЏбЇЗНГЬЪН_______________ЁЃЪЕбщНсЪјКѓЃЌСЂМДНЋ B жаШмвКЕЮМИЕЮдкзЯЩЋЪЏШяЪджНЩЯЃЌПЩЙлВьЕНЕФЯжЯѓЪЧ______________
ЃЈ2ЃЉзАжУ C ЕФЪЕбщФПЕФЪЧбщжЄТШЦјЪЧЗёОпгаЦЏАзадЃЌЮЊДЫ C жа IЁЂIIЁЂIII ДІвРДЮЗХШыЕФЮяжЪе§ШЗЕФЪЧ_________ЃЈЬюБрКХЃЉЁЃ
БрКХ | I | II | III |
A | ИЩдяЕФгаЩЋВМЬѕ | МюЪЏЛв | ЪЊШѓЕФгаЩЋВМЬѕ |
B | ИЩдяЕФгаЩЋВМЬѕ | ХЈСђЫс | ЪЊШѓЕФгаЩЋВМЬѕ |
C | ЪЊШѓЕФгаЩЋВМЬѕ | ХЈСђЫс | ИЩдяЕФгаЩЋВМЬѕ |
D | ЪЊШѓЕФгаЩЋВМЬѕ | МюЪЏЛв | ИЩдяЕФгаЩЋВМЬѕ |
ЃЈ3ЃЉД§ E жаЮяжЪЭъШЋЗДгІКѓЃЌОЙ§вЛЯЕСаМгЙЄДІРэЃЌЕУЕНЦЏАзЗлбљЦЗЃЌЦфжївЊГЩЗнЮЊ_________ЁЂ____________ЃЈЬюЛЏбЇЪНЃЉЁЃ
ЃЈ4ЃЉF зАжУЕФзїгУЪЧЃЈгУРызгЗНГЬЪНБэЪОЃЉ_____________
ЃЈ5ЃЉЮЊВтЖЈЃЈ3ЃЉжаЫљЕУЦЏАзЗлЕФгааЇГЩЗнКЌСПЁЃГЦШЁ a g ЦЏАзЗлбљЦЗШмНтЃЌЭљЫљЕУШмвКжаЭЈШы CO2 жСВЛдйВњЩњГСЕэЮЊжЙЃЌИУЙ§ГЬЕФЛЏбЇЗНГЬЪНЮЊ_____________ЁЃШєЗДгІЩњГЩГСЕэЕФЮяжЪЕФСПЮЊ b molЃЌдђИУЦЏАзЗлжагааЇГЩЗнЕФжЪСПЗжЪ§ЮЊ_________________ЃЈгУКЌ aЁЂb ЕФЪНзгБэЪОЃЉЁЃ
ЁОД№АИЁПCl2ЃЋH2O = HCl +HClO ЯШБфКьКѓЭЪЩЋ C CaCl2 Ca(ClO)2 Cl2ЃЋ2OH- = Cl-+ ClO-+H2O CO2+H2O+Ca(ClO)2 = CaCO3Ё§+2HClO 143b/a
ЁОНтЮіЁП
ЃЈ1ЃЉТШЦјКЭЫЎЗДгІЩњГЩбЮЫсКЭДЮТШЫсЁЃбЮЫсгаЫсадЃЌДЮТШЫсгаШѕЫсадКЭЦЏАзадЁЃ
ЃЈ2ЃЉИЩдяЕФТШЦјВЛОпгаЦЏАзадЃЌТШЦјКЭЫЎЗДгІЩњГЩЕФДЮТШЫсОпгаЦЏАзадЁЃ
ЃЈ3ЃЉТШЦјгыЧтбѕЛЏИЦЗДгІЩњГЩТШЛЏИЦЁЂДЮТШЫсИЦКЭЫЎЁЃ
ЃЈ4ЃЉТШЦјФмЙЛКЭЧтбѕЛЏФЦЗДгІЩњГЩТШЛЏФЦЃЌДЮТШЫсФЦКЭЫЎЁЃ
ЃЈ5ЃЉДЮТШЫсИЦКЭПеЦјжаЕФЖўбѕЛЏЬМКЭЫЎЗДгІЩњГЩЬМЫсИЦКЭДЮТШЫсЁЃвРОнЬМЫсИЦЕФЮяжЪЕФСПМЦЫуДЮТШЫсИЦЕФжЪСПЃЌШЛКѓМЦЫуЦфжЪСПЗжЪ§ЁЃ
ЃЈ1ЃЉТШЦјКЭЫЎЗДгІЩњГЩбЮЫсКЭДЮТШЫсЃЌBзАжУжаЗДгІЕФЛЏбЇЗНГЬЪНЮЊЃКCl2ЃЋH2O = HClЃЋHClOЁЃДЮТШЫсгаЦЏАзадЃЌНЋBжаШмвКЕЮдкзЯЩЋЪЏШяЪджНЩЯЃЌПЩЙлВьЕНЕФЯжЯѓЪЧЃКЪЏШяЪджНЯШБфКьКѓЭЪЩЋЁЃ
ЃЈ2ЃЉзАжУ C ЕФЪЕбщФПЕФЪЧбщжЄТШЦјЪЧЗёОпгаЦЏАзадЃЌЯШЭЈЙ§ЪЊШѓгаЩЋВМЬѕЃЌШчЙћгаЩЋВМЬѕЭЪЩЋЃЌжЄУїДЮТШЫсОпгаЦЏАзадЃЌШЛКѓЭЈЙ§ХЈСђЫсИЩдяГ§ШЅТШЦјжаЕФЫЎЗжЃЌдйЭЈШыИЩдягаЩЋВМЬѕЃЌгаЩЋВМЬѕВЛЭЪЩЋЃЌЫЕУїТШЦјВЛОпгаЦЏАзадЁЃД№АИЮЊCЁЃ
ЃЈ3ЃЉТШЦјгыЧтбѕЛЏИЦЗДгІЩњГЩТШЛЏИЦЁЂДЮТШЫсИЦКЭЫЎЃЌЦЏАзЗлжївЊГЩЗнЮЊCaCl2ЁЂCa(ClO)2ЁЃ
ЃЈ4ЃЉТШЦјгаЖОЃЌВЛФмжБНгХХЗХЕНПеЦјжаЁЃТШЦјФмЙЛКЭЧтбѕЛЏФЦЗДгІЩњГЩТШЛЏФЦЃЌДЮТШЫсФЦКЭЫЎЃЌЗДгІЕФРызгЗНГЬЪНЮЊЃКCl2ЃЋ2OH- = Cl-+ ClO-+H2OЁЃ
ЃЈ5ЃЉШЁ a gЦЏАзЗлбљЦЗШмНтЃЌЭљЫљЕУШмвКжаЭЈШы CO2 жСВЛдйВњЩњГСЕэЮЊжЙЃЌИУЙ§ГЬЕФЛЏбЇЗНГЬЪНЮЊЃКCO2+H2O+Ca(ClO)2 = CaCO3Ё§+2HClOЃЌЗДгІЩњГЩCaCO3ЕФЮяжЪЕФСПЮЊb molЃЌдђВЮгыЗДгІЕФДЮТШЫсИЦжЪСПm[Ca(ClO)2]=nM=b molЁС143g/mol=142bgЃЌИУЦЏАзЗлжаДЮТШЫсИЦжЪСПЗжЪ§ЮЊ![]() ЁС100%=
ЁС100%=![]() ЁЃ
ЁЃ


 УћаЃПЮЬУЯЕСаД№АИ
УћаЃПЮЬУЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгУMnO2бѕЛЏУмЖШЮЊ1.19gЁЄcmЃ3ЁЂШмжЪжЪСПЗжЪ§ЮЊ36.5%ЕФHClШмвКЁЃЗДгІЗНГЬЪНШчЯТЃКMnO2ЃЋ4HCl(ХЈ)![]() MnCl2ЃЋCl2ЁќЃЋ2H2OЁЃ
MnCl2ЃЋCl2ЁќЃЋ2H2OЁЃ
(1)аДГіИУЗДгІЕФРызгЗНГЬЪН______________________________ЁЃ
(2)ИУЗДгІЕФбѕЛЏМСЮЊ_____________ЃЌбѕЛЏВњЮяЪЧ___________ЁЃ
(3)17.4gMnO2Фмгы_____ФІЖћHClЗЂЩњЩЯЪіЗДгІЃПга______ФІЖћHClБЛбѕЛЏЃП
(4)ШєдкБъзМзДПіЯТВњЩњ4.48L Cl2ЃЌдђЗДгІжазЊвЦЕчзг_______ФІЖћЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаН№ЪєжаЃЌЙЄвЕЩЯГЃгУЕчНтЗЈвБСЖЕФЪЧ
A.CuB.AgC.FeD.Al
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПАБЦјЪЧвЛжжживЊЕФЛЏЙЄдСЯЃЌдкЩњВњЩњЛюжагазХЙуЗКЕФгІгУЃЌФГаЃбаОПадбЇЯАаЁзщЕФЭЌбЇбЇЯАЭъЕЊЕФгаЙиаджЪжЎКѓЃЌзМБИЖдАБЕФаджЪНјааЪЕбщЬНОПЁЃ
(1)ЪЕбщЪвжЦШЁАБЦјЕФЛЏбЇЗНГЬЪНЮЊ_________________________________ЁЃ
(2)ФГЭЌбЇФЃЗТХХБЅКЭЪГбЮЫЎЪеМЏТШЦјЕФЗНЗЈЃЌЯыгУХХБЅКЭТШЛЏяЇШмвКЕФЗНЗЈЪеМЏАБЦјЁЃФуШЯЮЊЫћФмЗёДяЕНФПЕФЃП________(ЬюЁАФмЁБЛђЁАЗёЁБ)ЃЌРэгЩЪЧ_________________________ЁЃ
(3)ИУаЁзщЕФЭЌбЇЩшМЦСЫШчЯТЭМЫљЪОЕФЪЕбщзАжУ(МаГжМАЮВЦјДІРэзАжУЮДЛГі)ЃЌЬНОПАБЦјЕФЛЙдадЁЃ
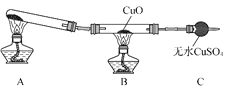
ЂйРћгУзАжУНјааЪЕбщЃЌЙлВьЕНCuOБфЮЊКьЩЋЮяжЪЃЌЮоЫЎCuSO4БфРЖЩЋЃЌЭЌЪБЩњГЩвЛжжЮоЮлШОЕФЦјЬхЁЃвбжЊКьЩЋЮяжЪЮЊвЛжжЕЅжЪЃЌдђАБЦјгыCuOЗДгІЕФЛЏбЇЗНГЬЪНЮЊ________________ЁЃ
ЂкгаЭЌбЇШЯЮЊЃКNH3гыCuOЗДгІЩњГЩЕФКьЩЋЮяжЪжаПЩФмКЌгаCu2OЁЃвбжЊЃКCu2OЪЧвЛжжМюадбѕЛЏЮяЃЌдкЫсадШмвКжаЃЌCuЃЋЈDЁњCuЃЋCu2ЃЋЁЃЧыЩшМЦвЛИіМђЕЅЕФЪЕбщМьбщИУКьЩЋЮяжЪжаЪЧЗёКЌгаCu2OЃК______________ЁЃ
(4)ИУаЁзщЕФЭЌбЇИљОн"КюЪЯжЦМюЗЈ"дРэЃЌНјааЬМЫсЧтФЦЕФжЦБИЃЌгаЙиЗДгІЮЊЃК
NH3+CO2+H2O=NH4HCO3ЃЛNH4HCO3+NaCl=NaHCO3Ё§+NH4ClЃЛ
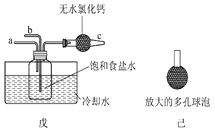
ФГЭЌбЇгУЩЯЭМжаЮьзАжУ(ЦфЫћзАжУЮДЛГі)НјааЪЕбщЁЃ
ЂйЪЕбщЪБЃЌаыЯШДгaЙмЭЈШы________ЦјЬх(ЬюЛЏбЇЪНЃЉЃЌШЛКѓДгbЙмГжајЭЈШыСэвЛжжЦјЬхЁЃ
ЂкгаЭЌбЇНЈвщдкЮьзАжУЕФbЙмЯТЖЫСЌНгМКзАжУЃЌРэгЩЪЧ____________________ЁЃ
ЂлЬМЫсЧтФЦЪмШШЫљЕУЙЬЬх12.28 gгызуСПЕФЪЏЛвЫЎГфЗжЗДгІЃЌЫљЕУГСЕэОЯДЕгЁЂИЩдяжЪСПЮЊ12.00 gЃЌдђЫљЕУЙЬЬхжаЬМЫсФЦЕФжЪСПЗжЪ§ЮЊ__________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПИжЬњЪЧФПЧАгІгУзюЙуЗКЕФН№ЪєВФСЯЃЌСЫНтИжЬњИЏЪДЕФдвђгыЗРЛЄЗНЗЈОпгаживЊвтвхЃЌЖдИжЬњжЦЦЗНјааПЙИЏЪДДІРэЃЌПЩЪЪЕБбгГЄЦфЪЙгУЪйУќЁЃ
ЃЈ1ЃЉПЙИЏЪДДІРэЧАЃЌЩњВњжаГЃгУбЮЫсРДГ§ЬњатЁЃЯжНЋвЛБэУцЩњатЕФЬњМўЗХШыбЮЫсжаЃЌЕБЬњатГ§ОЁКѓЃЌШмвКжаЗЂЩњЕФЛЏКЯЗДгІЕФЛЏбЇЗНГЬЪНЮЊЃК________________________ЁЃ
ЃЈ2ЃЉРћгУЯТЭМзАжУЃЌПЩвдФЃФтЬњЕФЕчЛЏбЇЗРЛЄЁЃ
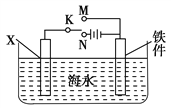
ЂйПЊЙиKЖЯПЊЪБЃЌЧвШєЮЊЩњЬњЃЌдђЬњМўжївЊЗЂЩњ_____ИЏЪДЃЛШєXЮЊЬМАєЃЌЮЊМѕЛКЬњМўЕФИЏЪДЃЌПЊЙиKгІжУгк________ДІЁЃ
ЂкШєXЮЊаПЃЌПЊЙиKжУгкMДІЃЌИУЕчЛЏбЇЗРЛЄЗЈГЦЮЊ________ЁЃ
ЃЈ3ЃЉЩЯЭМжаШєXЮЊДжЭЃЈКЌаПЕШдгжЪЃЉЃЌШнЦїжаКЃЫЎЬцЛЛЮЊСђЫсЭШмвКЃЌПЊЙиKжУгкNДІЃЌвЛЖЮЪБМфКѓЃЌЕБЬњМўжЪСПдіМг127 gЪБЃЌXЕчМЋШмНтЕФЭЕФжЪСП________127 g(ЬюЁА<ЁБЁА>ЁБЛђЁАЃНЁБ)ЁЃЬњМўБэУцЖЦЭПЩгааЇЗРжЙЬњБЛИЏЪДЃЌШчЙћЬњМўВПЗжЮДЖЦЩЯЭЃЌЛђЖЦВуЦЦЫ№ЃЌЖЦЭЬњБШЖЦаПЬњЗДЖјИќвзБЛИЏЪДЃЌЧыМђвЊЫЕУїдвђЃК__________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШтЙ№ЫсввѕЅДцдкЬьШЛЫеКЯЯужаЃЌОпгаРрЫЦЫЎЙћЕФЯуЦјЃЌЦјЯЂЧхУцЬ№ШѓЃЌЪЧвЛжждіЯуМСЃЌКЯГЩШтЙ№ЫсввѕЅЕФТЗЯпШчЭМЫљЪОЃЎ
вбжЊЃК
Ђй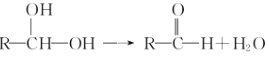
Ђк![]()
ЛиД№ЯТСаЮЪЬтЃК
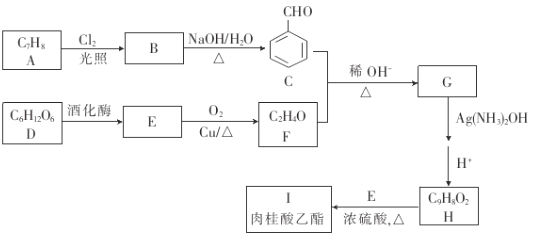
ЃЈ1ЃЉAЕФУћГЦЪЧ_____ЃЌCжаКЌгаЕФЙйФмЭХЕФУћГЦЪЧ_____ЃЎ
ЃЈ2ЃЉBЕФНсЙЙМђЪНЪЧ__ЃЌEЁњFЕФЗДгІРраЭЪЧ_____ЃЎ
ЃЈ3ЃЉGЗжзгжазюЖрга_____ИідзгЙВЦНУцЃЎ
ЃЈ4ЃЉH+EЁњIЕФЛЏбЇЗНГЬЪНЮЊ____ЃЎ
ЃЈ5ЃЉгыHЛЅЮЊЭЌЗжвьЙЙЬхЃЌЧвЭЌЪБТњзуЯТСаЬѕМўЕФгаЛњЮяЕФНсЙЙЃЈВЛПМТЧСЂЬхвьЙЙЃЉга________жжЃЎ
ЂйФмЗЂЩњвјОЕЗДгІЂкФмгыбѕЛЏЬњШмвКЗЂЩњЯдЩЋЗДгІЂлГ§БНЛЗЭтВЛКЌЦфЫћЛЗЦфжаКЫДХЙВеёЧтЦз5зщЗхЃЌЧвЗхУцЛ§жЎБШЮЊ1ЃК2ЃК2ЃК2ЃК1ЕФНсЙЙМђЪНЮЊ____ЃЎ
ЃЈ6ЃЉВЮееШтЙ№ЫсввѕЅЕФКЯГЩТЗЯпЃЌЩшМЦвЛЬѕвдEЮЊЦ№ЪМдСЯжЦБИ1ЉЖЁЯЉЕФКЯГЩТЗЯпЃК___ЃЎ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкЗДгІ3NO2ЃЋH2O=2HNO3ЃЋNOжаЃЌЗЂЩњЛЙдЗДгІКЭЗЂЩњбѕЛЏЗДгІЕФЮяжЪжЪСПжЎБШЮЊ( )
A.3ЁУ1
B.1ЁУ3
C.1ЁУ2
D.2ЁУ1
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПClO2ЪЧвЛжжЯћЖОЩБОњаЇТЪИпЁЂЖўДЮЮлШОаЁЕФЫЎДІРэМСЁЃЪЕбщЪвПЩЭЈЙ§вдЯТЗДгІжЦЕУClO2ЃК2KClO3+H2C2O4+H2SO4![]() 2ClO2Ёќ+K2SO4+2CO2Ёќ+2H2OЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ
2ClO2Ёќ+K2SO4+2CO2Ёќ+2H2OЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ
A. KClO3дкЗДгІжаЕУЕНЕчзг B. ClO2ЪЧЛЙдВњЮя
C. H2C2O4ЗЂЩњбѕЛЏЗДгІ D. 1 molKClO3ВЮМгЗДгІга2molЕчзгзЊвЦ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊNaHSO3ШмвКГЪЫсадЁЂNaHCO3ШмвКГЪМюадЁЃЯжгаХЈЖШОљЮЊ0.1mol/LЕФЕФNaHSO3ШмвККЭNaHCO3ШмвКЃЌШмвКжаИїСЃзгЕФЮяжЪЕФСПХЈЖШДцдкЯТСаЙиЯЕ(RБэЪОSЛђC)ЃЌЦфжае§ШЗЕФЪЧ( )
A. c(Na+)ЃОc(HRO3-)ЃОc(H+)ЃОc(RO32-)ЃОc(OH-) B. c(H+)ЃЋc(H2RO3)=c(RO32-)ЃЋc(OH-)
C. c(Na+)ЃЋc(H+)=c(HRO3-)ЃЋc(RO32-)ЃЋc(OH-) D. СНШмвКжаЕФc(Na+)ЁЂc(HRO3-)КЭc(RO32-)ЗжБ№ЯрЕШ
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com