
 已知,常温下H2S、H2CO3的电离常数如表
已知,常温下H2S、H2CO3的电离常数如表| Ka1 | Ka2 | |
| H2S | 9.1×10-8 | 1×10-15 |
| H2CO3 | 4.3×10-7 | 5.6×10-11 |
分析 (1)①电离常数越小,对应的盐溶液的碱性越强;
②S2-在溶液中存在两步水解;
(2)①HS-在溶液中的水解程度大于电离程度;
②当H2S与NaOH恰好反应生成Na2S时,溶液中水的电离程度最大;在b点溶液显中性,结合电荷守恒分析;
③可溶性铜盐与NaHS溶液反应生成CuS沉淀,结合离子方程式分析;
(3)黑色的Fe2S3固体加入足量的盐酸中,溶液中有淡黄色固体生成,淡黄色固体为S,可知S元素的化合价升高,则Fe元素的化合价降低;
(4)类比电解氯化钠饱和溶液的电解反应,写出电解硫化钠溶液的电解反应方程式,根据产物来说明反应的优点.
解答 解:(1)①电离常数越小,酸的酸性越弱,对应的盐溶液的碱性越强,硫氢根离子的电离常数小于碳酸氢根离子,则其水解程度大于碳酸根离子,所以硫化钠溶液的碱性强于碳酸钠溶液;
故答案为:硫化钠溶液;硫氢根离子的电离常数小于碳酸氢根离子,则其水解程度大于碳酸根离子;
②S2-在溶液中存在两步水解,水解的离子方程式为:S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-;
故答案为:S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-;
(2)①HS-在溶液中的水解程度大于电离程度,所以常温下,NaHS溶液显碱性;
故答案为:碱性;
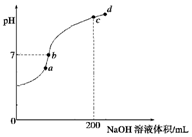
②常温下,向100mL 0.1mol•L-1 H2S溶液中滴加0.1mol•L-1NaOH溶液,当H2S与NaOH恰好反应生成Na2S时,溶液中水的电离程度最大,c点氢氧化钠的体积为20mL,H2S与NaOH恰好反应,所以c点水的电离程度最大;在b点溶液显中性c(OH-)=c(H+),溶液中电荷守恒为:c(Na+)+c(H+)=c(HS-)+c(OH-)+2c(S2-),溶液中各离子浓度由大到小的排列顺序是c(Na+)>c(HS-)>c(OH-)=c(H+)>c(S2-);
故答案为:c;c(Na+)>c(HS-)>c(OH-)=c(H+)>c(S2-);
③可溶性铜盐与NaHS溶液反应生成CuS沉淀,反应的离子方程式为Cu2++HS-=H++CuS↓;
故答案为:Cu2++HS-=H++CuS↓,使得氢离子浓度增大溶液pH减小;
(3)黑色的Fe2S3固体加入足量的盐酸中,溶液中有淡黄色固体生成,淡黄色固体为S,可知S元素的化合价升高,则Fe元素的化合价降低,结合H、Cl元素守恒可知,反应产物还有氯化亚铁、硫化氢,
故答案为:FeCl2;H2S;
(4)电解硫化钠溶液的电解反应方程式为:Na2S+2H2O$\frac{\underline{\;通电\;}}{\;}$S↓+H2↑+2NaOH,根据反应方程式可以得出:产物除硫单质外,还有H2和NaOH生成,所以该过程的优点是:副产物是氢气,生成的NaOH可循环利用;
故答案为:Na2S+2H2O$\frac{\underline{\;通电\;}}{\;}$S↓+H2↑+2NaOH;副产氢气,生成的NaOH可循环利用.
点评 本题考查了弱电解质的电离、盐类的水解和离子浓度大小的比较、酸碱混合的定性判断,题目难度中等,注意根据守恒思想解题,注意把握反应的先后顺序为解答的关键,涉及盐类的水解和离子浓度大小的比较,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 编号 | 实验目的 | 碳粉/g | 铁粉/g | 醋酸/% |
| ① | 为以下实验作参照 | 0.5 | 2.5 | 90.0 |
| ② | ? | 0.5 | 2.5 | 36.0 |
| ③ | 碳粉质量的影响 | 0.2 | ? | 90.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的压强不再变化 | B. | X、Y、Z的物质的量之比为2:1:1 | ||
| C. | 混合气体的密度不再变化 | D. | X的分解速率是Y的分解速率的两倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2可用于漂白纸浆 | B. | SiO2是良好的半导体材料 | ||
| C. | Na2O2可用作潜水艇O2来源 | D. | Cl2可用于消毒和制造漂白粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤⑦⑧ | B. | ①④⑥⑦ | C. | ①②③⑦⑧ | D. | ②③⑤⑥⑦⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com