
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.05 |
| 2 | 25.00 | 2.00 | 22.01 |
| 3 | 25.00 | 0.50 | 21.50 |
| 4 | 25.00 | 0.20 | 20.22 |
分析 (1)溶解时,需要烧杯、玻璃棒,转移时,需要容量瓶、玻璃棒,定容时,需要胶头滴管;
(2)①根据(NH4)2SO4溶液水解呈酸性,应该选用酸式滴定管;
②③根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对相关物理量的影响,以此判断浓度的误差;
④根据酚酞的变色范围确定滴定终点时颜色变化;
(3)先根据数据的有效性,舍去一组,标准溶液的体积应取三次实验的平均值,根据题意,中性甲醛溶液一定是过量的,而且1.500g 铵盐 经溶解后,取了其中1/10进行滴定,即0.15g,根据n=cV计算消耗氢氧化钠的物质的量,进而计算H+[含(CH2)6N4H+]的物质的量,根据方程式可知每生成4molH+[含(CH2)6N4H+]会消耗NH4+4mol,据此计算铵根离子物质的量,再计算氮元素的质量,据此计算解答.
解答 解:(1)步骤Ⅱ是配制中一定物质的量浓度的溶液,所需玻璃仪器除容量瓶外还有:烧杯、玻璃棒、胶头滴管;
故答案为:烧杯、玻璃棒、胶头滴管;
(2)①(NH4)2SO4溶液水解呈酸性,应该选用酸式滴定管量取,故答案为:酸式;
②滴定管用蒸馏水洗涤后,直接量取样品溶液,溶液被稀释,溶质的物质的量浓度偏小,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,c(待测)偏小,则测得样品中氮的质量分数偏低,故答案为:偏低;
③装标准液的滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,c(待测)偏大,则测得样品中氮的质量分数偏高,故答案为:偏高;
④待测液为酸性,酚酞应为无色,当溶液转为碱性时,溶液颜色变为浅红色,且半分钟内不褪色,说明到达终点;
故答案为:溶液刚好由无色变为浅红色,且半分钟内不褪色;
(3)标准溶液的4次体积分别为:20.03mL,20.01mL,21.00mL,20.02mL,第3组舍去,应取三次实验的平均值为20.02mL,
根据题意,中性甲醛溶液一定是过量的,而且1.500g 铵盐 经溶解后,取了其中1/10进行滴定,即0.15g,
滴定结果,溶液中含有H+[含(CH2)6N4H+]共0.0202L×0.1010mol•L-1=0.00202mol
根据方程式可知每生成4molH+[含(CH2)6N4H+]会消耗NH4+4mol,所以共消耗NH4+0.00204mol,
其中含氮元素0.00204mol×14g/mol=0.02856g
所以氮的质量分数为$\frac{0.02856g}{0.15g}$×100%=19.04%,
故答案为:19.04.
点评 本题考查物质的含量的测定,侧重于中和滴定的考查,注重于学生实验能力和分析能力和计算能力的综合考查,为考试高频考点,题目难度不大.


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入金属镁能产生H2的溶液中:Na+、Fe2+、SO42-、NO3- | |
| B. | 水电离产生的c(OH-)=1×10-10mol/L的溶液中:Al3+、SO42-、NO3-、Cl- | |
| C. | 无色透明溶液中:Al3+、Ca2+、Cl-、HCO3- | |
| D. | 含大量Fe3+的溶液中:K+、I-、NH4+、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 | B. | 0.2 | C. | 0.3 | D. | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有害垃圾 | B. | 不可回收垃圾 | C. | 可回收垃圾 | D. | 可堆肥垃圾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 理论解释( ) |
| A | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
| B | CO2为直线形分子 | CO2分子中C═O是极性键 |
| C | H2O的稳定性大于H2S | H2O分子间有氢键 |
| D | HF的沸点高于HCl | HF的相对分子质量小于HCl |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
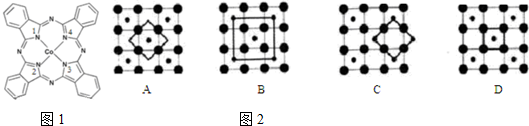
 ),在该晶体中与一个钴原子等距离且最近的钴原子有12个;筑波材料科学国家实验室一个科研小组发现了在 5K 下呈现超导性的晶体,该晶体具有CoO2的层状结构(如2所示,小球表示Co原子,大球表示O原子).下列用粗线画出的重复结构单元示意图不能描述CoO2的化学组成的是D.
),在该晶体中与一个钴原子等距离且最近的钴原子有12个;筑波材料科学国家实验室一个科研小组发现了在 5K 下呈现超导性的晶体,该晶体具有CoO2的层状结构(如2所示,小球表示Co原子,大球表示O原子).下列用粗线画出的重复结构单元示意图不能描述CoO2的化学组成的是D.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:N3->F->Na+ | |
| B. | 上述反应除①外都是氧化还原反应 | |
| C. | 反应②③中的水做氧化剂,每生成1mol H2,转移的电子数为2NA | |
| D. | 反④中的水是还原剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com