
| A. | 乙酸乙酯和水,酒精和水,植物油和水 | |
| B. | 四氯化碳和水,溴苯和苯,硝基苯和水 | |
| C. | 甘油和水,乙酸和水,乙酸和乙醇 | |
| D. | 汽油和水,苯和水,己烷和水 |
 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:解答题
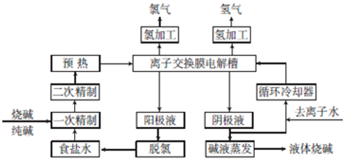
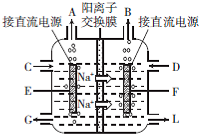
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | |
| Z | W |
| A. | 原子半径:W>Z>Y>X | |
| B. | 最高价氧化物对应水化物的酸性:Z>W>X | |
| C. | 气态氢化物的稳定性:Z>W | |
| D. | W的单质能与水反应,生成一种具有漂白性的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | A | L | M | Q | R | T | N |
| 原子半径/nm | 0.183 | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.152 |
| 主要化合价 | +1 | +2 | +3 | +6、-2 | +2 | -2 | +1 |
| A. | A、L、M三元素的金属性逐渐增强 | |
| B. | 在RCl2分子中,各原子均满足8电子的稳定结构 | |
| C. | Q元素的最高价氧化物为电解质,其水溶液能够导电 | |
| D. | A在T单质中燃烧所形成的化合物中含有共价键和离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
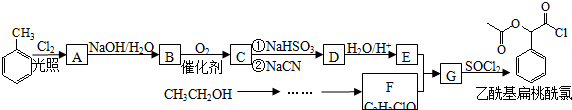
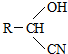 ,RCN$\stackrel{H_{2}O/H+}{→}$RCOOH,RCOOH$\stackrel{SOCl_{2}}{→}$RCOCl$\stackrel{R′OH}{→}$RCOOR′
,RCN$\stackrel{H_{2}O/H+}{→}$RCOOH,RCOOH$\stackrel{SOCl_{2}}{→}$RCOCl$\stackrel{R′OH}{→}$RCOOR′ .
. .
. .
.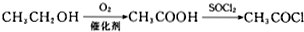 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
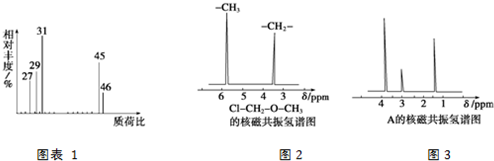
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | C | D | E |
| ①能使溴的四氯化碳溶液褪色; ②比例模型为: 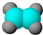 ③能与水在一定条件下反应生成C | ①由C、H两种元素组成; ②球棍模型为: 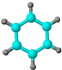 | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与E反应生成相对分子质量为100的酯. | ①相对分子质量比C少2; ②能由C氧化而成; | ①由C、H、O三种元素组成; ②球棍模型为: 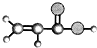 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com