
| A. | 溶液中导电粒子的数目减少 | |
| B. | 溶液中的值$\frac{C{H}_{3}COOH}{C{H}_{3}CO{O}^{-}}$减小 | |
| C. | 醋酸的电离程度增大,c(H+)亦增大 | |
| D. | 再加入10mlpH=11的NaOH溶液,混合液pH=7 |
分析 醋酸是弱电解质,则室温下向10mLpH=3的醋酸溶液中加水稀释后会促进醋酸的电离,溶液中醋酸分子数减小、醋酸根离子、氢离子的数目增大,则溶液中离子的数目增多、$\frac{C{H}_{3}COOH}{C{H}_{3}CO{O}^{-}}$的值减小;由于溶液的体积增大,则电离产生的离子的浓度减小,再结合酸碱混合时pH的计算来解答.
解答 解:A.因醋酸溶液中加水稀释,促进电离,则液中导电粒子的数目增多,故A错误;
B.稀释后醋酸的电离程度增大,则溶液中醋酸的分子数减小,醋酸根离子的数目增大,由于在同一溶液中,则$\frac{C{H}_{3}COOH}{C{H}_{3}CO{O}^{-}}$的值减小,故B正确;
C.加水稀释时,溶液的体积增大的倍数大于n(H+)增加的倍数,则c(H+)减小,故C错误;
D、等体积10mLpH=3的醋酸与pH=11的NaOH溶液混合时,醋酸的浓度大于0.001mol/L,醋酸过量,则溶液的pH<7,故D错误;
故选B.
点评 本题考查弱电解质电离平衡及其影响,题目难度不大,明确弱电解质的电离平衡及其影响、溶液的pH与物质的量浓度的关系、稀释中溶液体积的变化与离子的物质的量的变化程度是解答本题的关键.


科目:高中化学 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:实验题
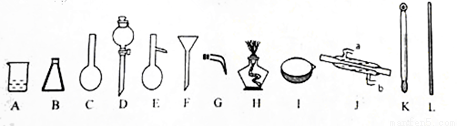
(1)填写以下仪器的名称:B D E
(2)用四氯化碳提取出溴水中Br2的方法是: ,将Br2的四氯化碳溶液和水分离开的操作是:
(3)已知Br2的沸点是58.5℃,四氯化碳沸点是78℃。将Br2的四氯化碳溶液中的Br2分离出来的操作是 。该操作需要用到的玻璃仪器有(填字母) 。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | HCl | C. | CaCO3(固体) | D. | H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
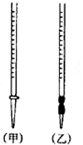 用中和滴定法测定某烧碱样品的纯度.有以下步骤:
用中和滴定法测定某烧碱样品的纯度.有以下步骤:| 测定序号 | 待测溶液的体积(mL) | 所耗盐酸标准液的体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 1 | 20.00 | 0.50 | 20.78 |
| 2 | 20.00 | 1.20 | 21.32 |
| 3 | 20.00 | 0.40 | 21.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
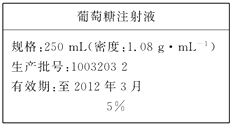 为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液,下页图是医院给病人输液时使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液的标签.某学生欲在实验室中配制500mL该葡萄糖注射液.
为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液,下页图是医院给病人输液时使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液的标签.某学生欲在实验室中配制500mL该葡萄糖注射液.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应CO2(g)+C(s)=2CO(g)在高温下可自发进行,则该反应的△H>0 | |
| B. | 工业上电解饱和食盐水时,以石墨作阴极,铁棒作阳极 | |
| C. | 常温下,0.1mol•L-1 CH3COOH溶液pH=1 | |
| D. | 常温下,在AgCl悬浊液中加入少量NaCl饱和溶液,c(Ag+)减小,Ksp(AgCl) 减小和溶液的pH均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验操作 | 现 象 | 有关的化学方程式 |
| 实验一:取少量固体样品,滴加稀盐酸,然后将产生的气体通入澄清石灰水 | 有气泡产生 澄清石灰水变浑浊 | Na2CO3+2HCl=2NaCl+H2O+CO2↑ CO2+Ca(OH)2=CaCO3↓+H2O |
| 实验二:取少量固体样品, 加水配成溶液,滴加适量的氯化钙或 氯化钡等 溶液 | 有白色沉淀产生 | Na2CO3+CaCl2=CaCO3↓+2NaCl或 Na2CO3+BaCl2=BaCO3↓+2NaCl等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH+OH-═CH3COO-+H2O | B. | H++OH-═H2O | ||
| C. | CH3COOH+OH-+Na+═CH3COONa+H2O | D. | CH3COOH+NaOH═CH3COO-+Na++H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com