
 为了实现“将全球温度上升控制在2℃以内”,科学家正在研究温室气体CH4和CO2的转化和利用.
为了实现“将全球温度上升控制在2℃以内”,科学家正在研究温室气体CH4和CO2的转化和利用. ,Ni能与CO形成正四面体形的配合物Ni(CO)4,1molNi(CO)4中含有σ键的数目为8NA.
,Ni能与CO形成正四面体形的配合物Ni(CO)4,1molNi(CO)4中含有σ键的数目为8NA.分析 (1)A.由不同种元素的原子组成的共价键为极性键,空间构型为对称型的是非极性分子;
B.同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素;
C.不含有氢键的分子晶体,相对分子质量大的沸点高;
D.根据CH3+离子的价层电子对数以及杂化轨道类型判断CH3+离子的空间构型;
(2)①Ni是28号元素,其原子核外有28个电子,根据构造原理写出基态Ni原子核外电子排布式;
②原子个数相等、价电子数相等的微粒互为等电子体;该配合物的配离子中Ni原子和C原子、CO分子中C原子和O原子之间都存在σ键;
(3)①CH3COOH中C原子分别形成4个、3个δ键,没有孤对电子,根据杂化理论判断;②利用均摊法计算该晶胞中含有的原子个数,从而确定其化学式.
解答 解:(1)A.CH4分子中含有极性共价键C-H,空间构型为正四面体结构,为非极性分子,CO2 中C=O为极性键,二氧化碳为直线型,所以是非极性分子,故A正确;
B.同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素,故第一电离能顺序为:N>O>C,故B错误;
C.CH4、SnH4、GeH4、SiH4属于都不含有氢键的分子晶体,相对分子质量大的沸点高,所以沸点高低:SnH4>GeH4>SiH4>CH4,故C错误;
D.CH3+离子的价层电子对数=3+$\frac{4-1-1×3}{2}$=3,为sp2杂化,故D正确;
故答案为:AD;
(2)①Ni的原子序数为28,根据能量最低原理可写出电子排布式为1S22S22P63S23P63d84s2,
故答案为:1S22S22P63S23P63d84s2;
②CO分子中含有2个原子、价电子数是10,与CO互为等电子体的与CO互为等电子体的阴离子微粒有CN-或C22-,其电子式为 ,该配合物的配离子中Ni原子和C原子之间有4个σ键,CO分子中C和O之间存在1个σ键,1个π键,1个配位键,因此4个CO有4个σ键,故1mol Ni(CO)4中含有8molσ键即8NA,
,该配合物的配离子中Ni原子和C原子之间有4个σ键,CO分子中C和O之间存在1个σ键,1个π键,1个配位键,因此4个CO有4个σ键,故1mol Ni(CO)4中含有8molσ键即8NA,
故答案为: ;8NA;
;8NA;
(3)①CH3COOH中C原子分别形成4个、3个δ键,没有孤对电子,分别为sp3杂化、sp2杂化,
故答案为:sp3和sp2;
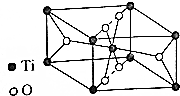
②该晶胞中氧原子个数为4×$\frac{1}{2}$+2=4,钛原子个数=8×$\frac{1}{8}$+1=2,所以化学式为TiO2,
故答案为:TiO2.
点评 本题考查化学键、电离能、离子的空间构型、晶胞计算、原子杂化方式判断、等电子体、原子核外电子排布等知识点,为高频考点,侧重考查学生知识运用能力及空间想象能力,易错点是价层电子对个数的计算方法,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 活性炭与新制氯水的漂白原理相同 | |
| B. | 过氧化钠常用于羽绒制品的漂白 | |
| C. | 漂白粉是由Ca(ClO)2组成的纯净物 | |
| D. | 将漂白剂SO2和NaClO混合使用可增加漂白效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C生成的速率与C分解的速率相等 | |
| B. | 单位时间生成n molA 同时生成3n molB | |
| C. | A、B、C的浓度相等 | |
| D. | A、B、C的分子数比为1:2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室需要配制0.1 mol•L-1NaOH溶液500 mL,回答下列问题
实验室需要配制0.1 mol•L-1NaOH溶液500 mL,回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24L Cl2通入足量水中或NaOH溶液中,转移的电子数均为0.1NA. | |
| B. | 1mol CnH2n含有的共用电子对数为(3n+1)NA | |
| C. | 电解精炼铜时,若阳极质量减少6.4g,则电路中转移电子书为0.2NA | |
| D. | 2gD2160中含中子、质子、电子数目均为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
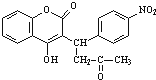
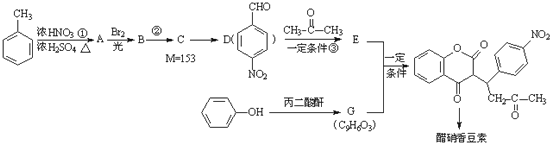
 +H2O
+H2O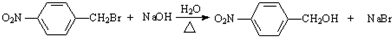 .
.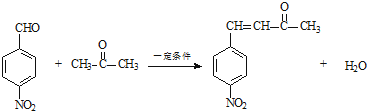 .
.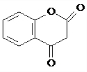 .
.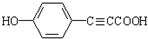 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
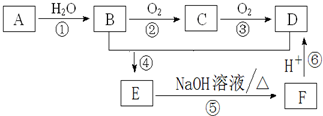 已知:烃 A的摩尔质量为28g/mol,有关A的转化关系如图所示,请回答下列问题:
已知:烃 A的摩尔质量为28g/mol,有关A的转化关系如图所示,请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com