


 ‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗ
‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ≤Μœξ Χβ–ΆΘΚΒΞ―ΓΧβ
AΘ° ·Μ“»ι”κ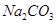 »ή“ΚΜλΚœΘΚ »ή“ΚΜλΚœΘΚ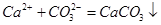 |
BΘ°”ΟΕη–‘ΒγΦΪΒγΫ⬻̷ΟΨ»ή“ΚΘΚ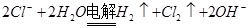 |
CΘ°ΫΪΧΦ”κΉψΝΩΒΡ≈®ΝρΥαΙ≤»»Ζ¥”ΠΚσΒΡΤχΧεΜλΚœΈοΘ§Ά®»κΙΐΝΩ«β―θΜ·ΡΤ»ή“Κ÷–ΘΚ |
DΘ°84œϊΕΨ“ΚΚΆΫύ≤όΝιΜλΚœ Ι”ΟΜα≤ζ…ζ”–ΕΨΤχΧεΘΚ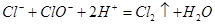 |
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ≤Μœξ Χβ–ΆΘΚΒΞ―ΓΧβ
| AΘ°≈®…’Φν»ή“Κ÷–Φ”»κ¬ΝΤ§ΘΚAlΘΪ2OH-=AlO2-ΘΪ H2Γϋ |
| BΘ°…ΌΝΩΡΤΆΕ»κCuSO4»ή“Κ÷–ΘΚ2NaΘΪCu2+ΘΪ2H2O=2 Na+ΘΪCu(OH)2ΓΐΘΪH2Γϋ |
| CΘ°ΧΦΥαΗΤ”κ―ΈΥαΖ¥”ΠΘΚCO32-ΘΪ2H+= H2OΘΪCO2Γϋ |
| DΘ°œΓΝρΥα÷–Φ”»κΧζΖέΘΚ2FeΘΪ6H+=2Fe3+ΘΪ3H2Γϋ |
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ≤Μœξ Χβ–ΆΘΚΒΞ―ΓΧβ
AΘ°¬»ΤχΆ®»κΥ°÷–Θ§»ή“Κ≥ Υα–‘ΘΚCl2+H2O  2H++ClΘ≠+ClOΘ≠ 2H++ClΘ≠+ClOΘ≠ |
BΘ°”ΟΆ≠ΉωΒγΦΪΒγΫβCuSO4»ή“ΚΘΚ2Cu2ΘΪΘΪ2H2O 2Cu ΘΪO2ΓϋΘΪ4HΘΪ 2Cu ΘΪO2ΓϋΘΪ4HΘΪ |
CΘ°NaHSΒγάκΖΫ≥Χ ΫΘΚNaHS  NaΘΪ+HSΘ≠ NaΘΪ+HSΘ≠ |
DΘ°NH4ClΥ°ΫβΖ¥”ΠΘΚNH4+ΘΪ2H2O  NH3ΓΛH2O+H3O+ NH3ΓΛH2O+H3O+ |
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ≤Μœξ Χβ–ΆΘΚΒΞ―ΓΧβ
| AΘ°≥Έ«εΒΡ ·Μ“Υ°”κœΓ―ΈΥαΖ¥”ΠCa(OH)2+2H+=Ca2++2H2O |
| BΘ°ΡΤ”κΥ°ΒΡΖ¥”ΠNa+2H2O=Na++2OH-+ H2 Γϋ |
| CΘ°ΝρΥα«βΡΤ»ή“Κ”κ…ΌΝΩ«β―θΜ·±Β»ή“ΚΜλΚœΘΚ2H++SO42Θ≠+ Ba2++2OHΘ≠ΘΫ BaSO4Γΐ+2H2O |
DΘ°œρΖ–Υ°÷–ΒΈΦ”FeCl3»ή“Κ÷Τ±ΗFe(OH)3ΫΚΧεΘΚFe3+ΘΪ3H2O Fe(OH)3ΓΐΘΪ3H+ Fe(OH)3ΓΐΘΪ3H+ |
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ≤Μœξ Χβ–ΆΘΚΒΞ―ΓΧβ
| AΘ°Ba(OH)2»ή“ΚΚΆœΓH2SO4ΒΡΖ¥”Π | BΘ°NaOH»ή“ΚΚΆ―ΈΥαΖ¥”Π |
| CΘ°Cu(OH)2ΚΆœΓH2SO4ΒΡΖ¥”Π | DΘ°NaOH»ή“ΚΚΆCO2ΒΡΖ¥”Π |
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ≤Μœξ Χβ–ΆΘΚΒΞ―ΓΧβ
| AΘ°Α±Υ°÷–Ά®»κΙΐΝΩCO2ΘΚ2NH3ΓΛH2O +CO2= 2NH4++CO32-+H2O |
| BΘ°œΓœθΥα÷–Φ”»κΙΐΝΩΧζΖέΘΚ3Fe + 8HΘΪ+2 NO3Θ≠= 3Fe2ΘΪ+ 2NOΓϋ + 4H2O |
| CΘ°ΡΤ”κΥ°Ζ¥”ΠNa+2H2O= Na+ +2OHΘ≠+H2 Γϋ |
| DΘ°Ca(ClO)2»ή“Κ÷–Ά®»κΙΐΝΩΒΡΕΰ―θΜ·ΝρΤχΧεΘΚClO-+SO2+H2O= HClO+HSO3- |
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ≤Μœξ Χβ–ΆΘΚΒΞ―ΓΧβ
| AΘ°ΦΉΆιΒΡ±ξΉΦ»Φ…’»»ΈΣ-890.3kJΓΛmol-1Θ§‘ρΦΉΆι»Φ…’ΒΡ»»Μ·―ßΖΫ≥Χ ΫΩ…±μ ΨΈΣΘΚCH4(g)+2O2(g)ΘΫCO2(g)+2H2O(g)ΓςHΘΫΘ≠890.3kJΓΛmol-1 |
BΘ° 500ΓφΓΔ30MPaœ¬Θ§ΫΪ0.5mol N2ΚΆ1.5molH2÷Ο”ΎΟή±’ΒΡ»ίΤς÷–≥δΖ÷Ζ¥”Π…ζ≥…NH3(g)Θ§Ζ≈»»19.3kJΘ§Τδ»»Μ·―ßΖΫ≥Χ ΫΈΣΘΚN2(g)ΘΪ3H2(g) 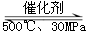 2NH3(g)ΓςHΘΫΘ≠38.6kJΓΛmol-1 2NH3(g)ΓςHΘΫΘ≠38.6kJΓΛmol-1 |
| CΘ°¬»Μ·ΟΨ»ή“Κ”κΑ±Υ°Ζ¥”ΠΘΚMg2ΘΪΘΪ2OHΘ≠ΘΫMg(OH)2Γΐ |
| DΘ°―θΜ·¬Ν»ή”ΎNaOH»ή“ΚΘΚAl2O3+2OH-+3H2OΘΫ2Al(OH)4Θ≠ |
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ≤Μœξ Χβ–ΆΘΚΒΞ―ΓΧβ
| AΘ°¬Ν”κœΓ―ΈΥαΖ¥”Π AlΘΪ2HΘΪ=Al3ΘΪΘΪH2Γϋ |
| BΘ°»ΐ¬»Μ·Χζ»ή“Κ”κ«β―θΜ·ΡΤ»ή“ΚΖ¥”Π FeCl3ΘΪ3OHΘ≠=Fe(OH)3ΓΐΘΪ3ClΘ≠ |
| CΘ°”Ο«β―θΜ·ΡΤ»ή“ΚΈϋ ’Εύ”ύΒΡCl2ΘΚCl2ΘΪ2OHΘ≠ΘΫClΘ≠ΘΪClOΘ≠ΘΪH2O |
| DΘ°Εΰ―θΜ·ΧΦ”κ ·Μ“Υ°Ζ¥”Π CO2ΘΪ2OHΘ≠=CO32Θ≠ΘΪH2O |
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΑΌΕ»÷¬–≈ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com