
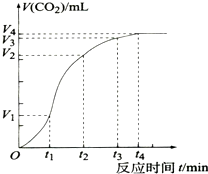
 为了研究CaCO3与稀盐酸反应的反应速率,某同学通过实验测定反应中生成的CO2气体体积随反应时间变化的情况,绘制曲线(图),已知该反应是放热反应,请分析讨论以下问题:
为了研究CaCO3与稀盐酸反应的反应速率,某同学通过实验测定反应中生成的CO2气体体积随反应时间变化的情况,绘制曲线(图),已知该反应是放热反应,请分析讨论以下问题:分析 (1)根据图象知,曲线的斜率为该反应的化学反应速率,斜率越大其反应速率越大,相同的时间段里,收集到气体最多;
(2)根据影响化学反应的影响因素进行分析;
(3)反应结束,产生的气体二氧化碳达到最大量.
解答 解:(1)曲线的斜率为该反应的化学反应速率,斜率越大其反应速率越大,根据图象知,斜率最大的是t1~t2,所以速率最快,相同的时间段里,收集到气体最多,
故答案为:t1~t2;t1~t2;
(2)0~t1反应物的浓度较大,速率较快;t1~t2随反应的进行,反应物的浓度是减小的,但速率是增大的,这说明反应一定是放热反应,温度升高导致反应速率增大;t2~t3随反应的进行,反应物的浓度越来越小,起到主要作用,反应速率减小,
答:0~t1反应物的浓度较大,速率较快;t1~t2随反应的进行,反应物的浓度是减小的,但速率是增大的,这说明反应一定是放热反应,温度升高导致反应速率增大;t2~t3随反应的进行,反应物的浓度越来越小,起到主要作用,反应速率减小;
(3)t4后,反应结束,产生的气体二氧化碳达到最大量,所以气体的体积不在增加,
答:反应结束,产生的气体二氧化碳达到最大量.
点评 本题考查了化学反应速率的影响因素,知道浓度、温度对化学反应速率的影响,再结合速率公式分析解答,知道斜率与速率的关系,题目难度不大.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 电解法:MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑ | |
| B. | 热还原法:Fe2O3+3CO$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2 | |
| C. | 热分解法:2Al2O3═4Al+3O2↑ | |
| D. | 物理方法:利用密度大的性质水洗矿物提取金 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按照系统命名法,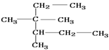 的名称为2,3-二甲基-2-乙基戊烷 的名称为2,3-二甲基-2-乙基戊烷 | |
| B. | 除去苯中 的方法:加溴水,充分振荡,静置分液 的方法:加溴水,充分振荡,静置分液 | |
| C. | 1mol 最多能与4mol氢氧化钠反应 最多能与4mol氢氧化钠反应 | |
| D. | 苯乙烯中所有原子不可能共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌与稀硫酸反应:Zn+2H+═Zn2++H2↑ | |
| B. | FeCl3溶液中加入氢氧化钠溶液:Fe3++3OH-═Fe(OH)3(胶体) | |
| C. | Ca(NO3)2溶液中滴加少量的Na2CO3溶液:Ca2++CO32-═CaCO3↓ | |
| D. | 常温下氯气与苛性钠溶液反应:Cl2+2OH-═Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KCl和SO2溶于水后能导电,故KCl和SO2为电解质 | |
| B. | AgCl沉淀易转化为AgI沉淀,故K(AgI)<K(AgCl) | |
| C. | 电解精炼铜时,粗铜作阴极,纯铜作阳极 | |
| D. | 25℃时,用醋酸溶液滴定等浓度NaOH溶液至pH=7时,两溶液体积:V醋酸<VNaOH |
查看答案和解析>>
科目:高中化学 来源:2017届江苏省如皋市高三上学期质量调研一化学试卷(解析版) 题型:填空题
将不可再生的天然气、石油、煤等化石燃料转化利用、变废为宝已成为当务之急。
(1)根据键能数据估算CH4+4F2=CF4+4HF的反应热ΔH= 。
化学键 | C—H | C—F | H—F | F—F |
键能/(kJ·mol-1) | 414 | 489 | 565 | 155 |
(2)甲醇、二甲醚(CH3OCH3)被称为21世纪的新型燃料,均可利用CO和H2反应合成。
①某燃料电池以二甲醚为原料,熔融碳酸盐为电解质,其负极反应如下:
CH3OCH3+6CO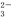 -12e-=8CO2+3H2O。写出该燃料电池的正极反应式: 。
-12e-=8CO2+3H2O。写出该燃料电池的正极反应式: 。
②废水中含甲醇对水质会造成污染,Co3+可将甲醇氧化为CO2。某同学以Pt作电极电解酸性含甲醇废水与CoSO4混合液模拟工业除污原理,其阳极反应式为 。
(3)某企业采用如图所示原理处理化石燃料开采、加工过程产生的H2S废气。
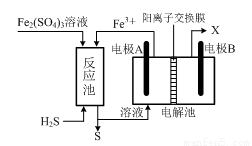
①电解池中电极A、B均为惰性电极,其中A为电解池的 极;电极B所得到的物质X的分子式为 。
②反应池中发生的离子反应方程式为 。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省如皋市高三上学期质量调研一化学试卷(解析版) 题型:选择题
下列图示与对应的叙述相符的是
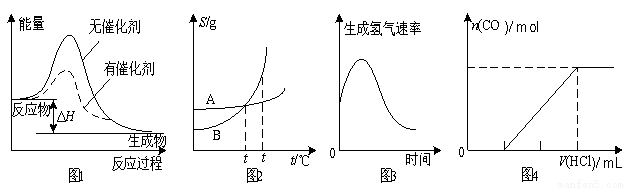
A.图1表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图2表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
C.图3表示镁条放入盐酸中生成氢气速率随时间的变化,起初反应速率加快的原因可能是该反应为放热反应
D.图4表示在含等物质的量NaOH、Na2CO3的混合溶液中滴加0.1 mol·L-1盐酸至过量时,产生气体的体积与消耗盐酸的关系
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
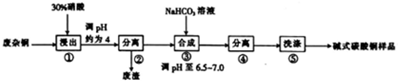
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com